- 首页
- 资讯
香港科技大学孙建伟课题组Angew: 通过不对称1,8-共轭加成反应构建四取代手性联烯类化合物
来源:化学加编辑部 暖冬 2020-07-17
导读:香港科技大学孙建伟课题组报道了手性磷酸催化吲哚取代的炔丙醇与3-苯基吲哚或1-萘酚的不对称1,8-共轭加成反应,能以良好至优秀的收率及对映选择性得到一系列四取代联烯化合物。同时,对照实验的结果表明远程控制的1,8-共轭加成反应中涉及的原位生成的吲哚亚甲基亚胺(indole imine methide)类化合物是通过双功能过渡态转化而来的。该成果发表在Angew. Chem. Int. Ed.上(DOI: 10.1002/anie.202006137)。
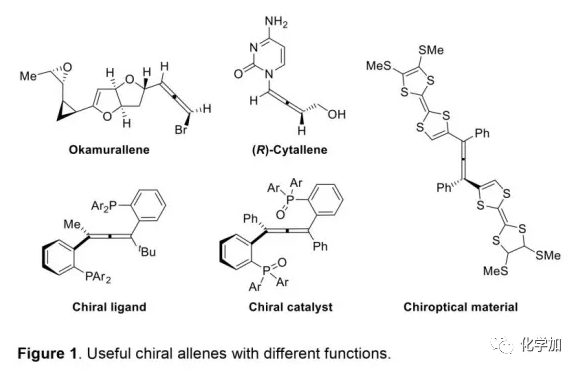
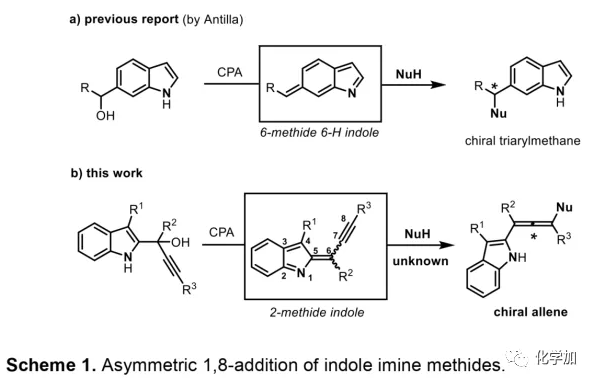
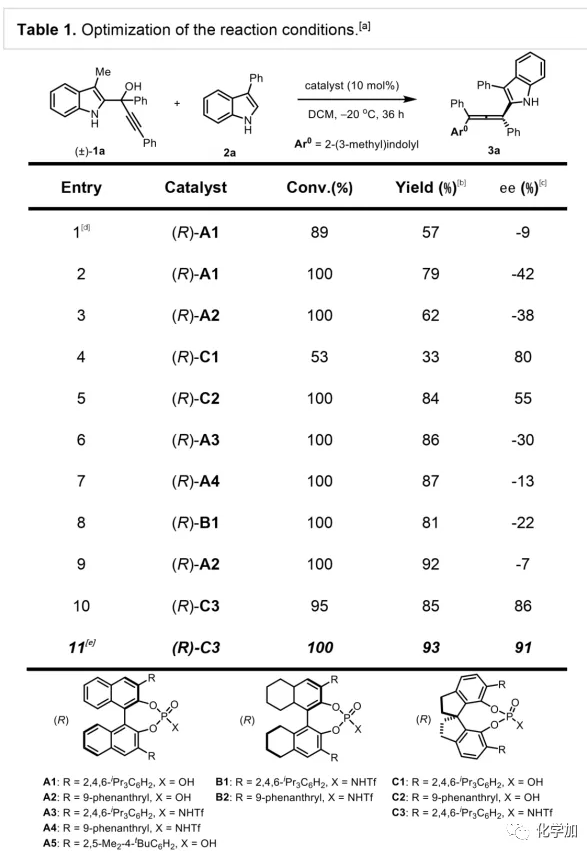
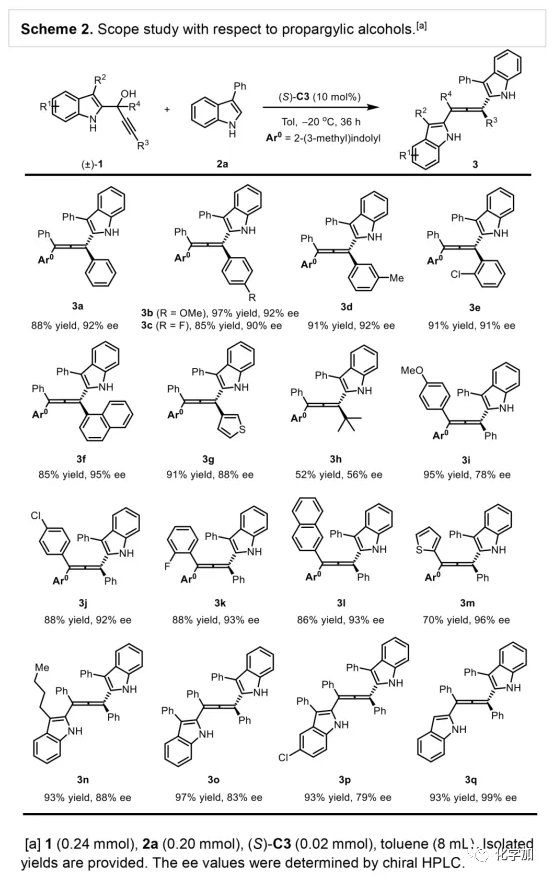
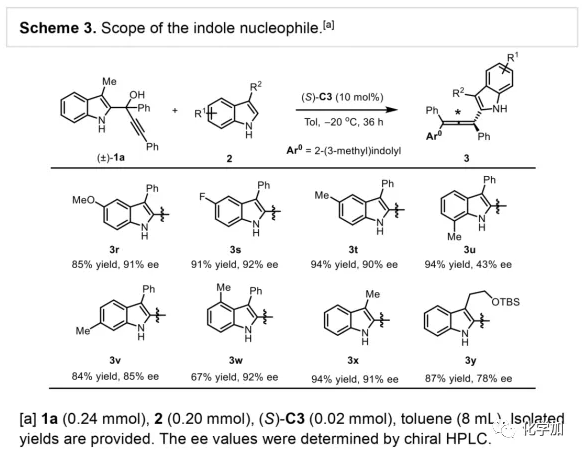
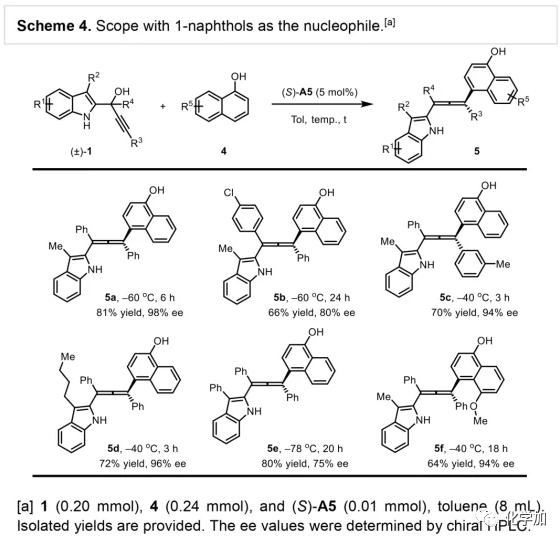
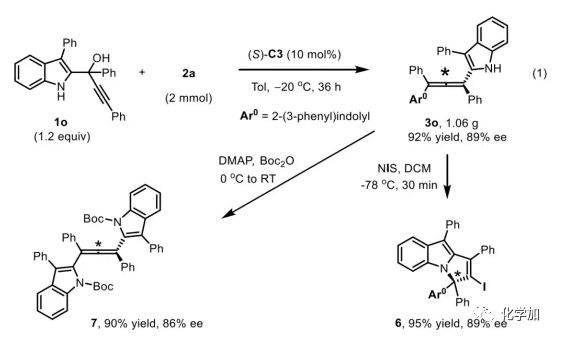
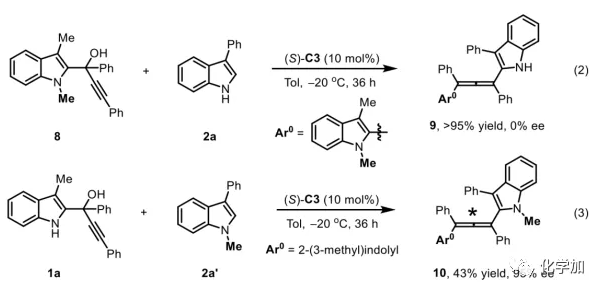
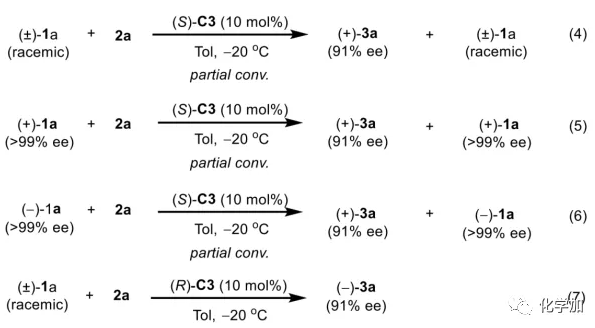
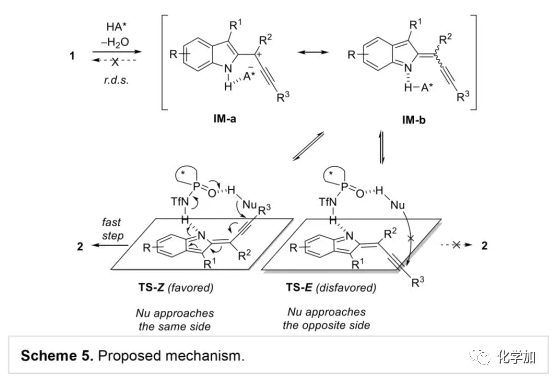
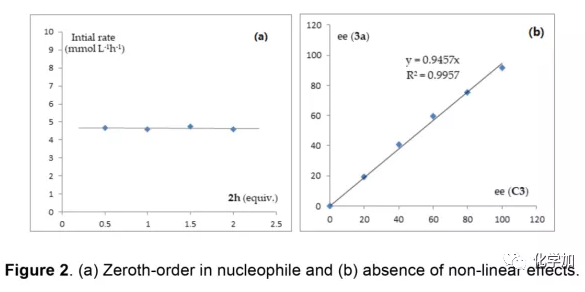
轴手性联烯类化合物广泛存在于天然产物、药物、配体、有机催化剂以及多功能材料中(Figure 1),因此,轴手性联烯类化合物的不对称合成成为化学家们关注的重点。传统的合成轴手性联烯类化合物的方法主要包括消旋联烯类化合物的拆分和手性炔丙醇前体的转化这两种。随着时代的发展,不对称合成轴手性联烯类化合物已经取得了不错的进展,但有机催化合成轴手性联烯类化合物仍然面临巨大挑战。 (图片来源:Angew. Chem. Int. Ed.)手性吲哚衍生物是多种具有生物活性的天然产物和药物的核心结构。而吲哚醇原位生成相应的亚胺类化合物与亲核试剂反应是合成手性吲哚衍生物最直接有效的方法,但这种吲哚亚甲基亚胺类化合物主要局限于环加成反应、1,4-或1,6-共轭加成反应,而远程控制吲哚亚甲基亚胺类化合物的1,8-共轭加成仍然面临巨大挑战。最近,Antilla课题组成功实现了手性磷酸催化富电子芳烃与6-甲基-6H-吲哚不对称1,8-加成反应(Scheme 1a)。受到该报道的启发,香港科技大学孙建伟课题组报道了手性磷酸催化吲哚衍生的炔丙醇与3-苯基吲哚或1-萘酚的远程不对称1,8-共轭加成反应,能以良好至优秀的收率及对映选择性得到一系列四取代联烯化合物(Scheme 1b)。(图片来源:Angew. Chem. Int. Ed.)作者以消旋的炔丙醇1a和3-苯基吲哚2a为模板底物,通过对催化剂、溶剂以及温度等反应条件进行筛选,确定最优的反应条件(Table 1):10 mol% (S)-C3为催化剂,甲苯为溶剂,在-20 ℃条件下反应36 h,能以88%的收率和92%的对映选择性得到产物3a。(图片来源:Angew. Chem. Int. Ed.)在最优反应条件下,作者对炔丙醇的底物范围进行了考察(Scheme 2)。各种芳基取代、杂环取代以及位阻较大的萘环、叔丁基取代的炔丙醇都能较好的适应反应条件,能以良好至优秀的收率和对映选择性得到相应产物。但4-甲氧基苯基取代的炔丙醇则只能以较低的对映选择性得到相应产物,可能是因为4-甲氧基苯基基团与2-吲哚基团在阳离子中间体的形成中存在竞争关系。(图片来源:Angew. Chem. Int. Ed.)接着,作者考察了3-苯基吲哚的底物范围(Scheme 3)。各种C4-位、C5-位和C6-位取代的3-苯基吲哚以及3-烷基吲哚均能较好的适应反应条件,能以良好至优秀的收率及对映选择性得到相应产物。但C7-位甲基取代的3-苯基吲哚则只能以较低的对映选择性得到相应产物,可能是因为C7-位的甲基会影响N-H键与手性磷酸氢键的形成。(图片来源:Angew. Chem. Int. Ed.)1-萘酚也可作为亲核试剂参与该类不对称共轭加成反应(Scheme 4)。通过简单优化反应条件,作者确定1-萘酚与炔丙醇发生不对称1,8-共轭加成反应的最优反应条件。同时,在最优反应条件下,各种炔丙醇与1-萘酚4都能较好的适应反应条件,能以良好至优秀的收率及对映选择性得到相应联烯产物。(图片来源:Angew. Chem. Int. Ed.)为了证明该反应的应用潜力,作者进行了放大规模反应和衍生反应(Eq. 1)。将2a的用量扩大至2 mmol,产物的收率及对映选择性均没有明显的降低。3o在NIS的二氯甲烷溶液中可发生轴手性到碳中心手性的转化,得到杂环化合物6。同时,3o中的N-H可被Boc基团保护,从而可以进行更多的衍生反应而不受N-H基团的影响。其中,3o和6的绝对构型通过单晶确定。(图片来源:Angew. Chem. Int. Ed.)为了进一步了解反应机理,作者进行了一系列对照实验。N-甲基取代的炔丙醇8能顺利发生1,8-共轭加成反应,但得到的产物的对映选择性为0,这说明N-H键对反应对映选择性的控制起着至关重要的作用(Eq. 2)。N-甲基吲哚2a′能与炔丙醇发生反应,能以中等的收率和优秀的对映选择性得到相应产物,这说明亲核试剂的N-H键可以加速反应的进行(Eq. 3)。(图片来源:Angew. Chem. Int. Ed.)为了证明反应是否经历SN2'过程和动力学拆分过程,作者又进行了一系列对照实验。标准反应条件下,作者监测反应产物和炔丙醇的ee值,发现产物的ee值保持在91%且消旋的炔丙醇也一直保持在消旋状态(Eq. 4)。此外,作者利用(+)-1a或(-)-1a分别参与反应,分别得到相同构型的产物(+)-3a或(-)-3a,回收底物的ee值也保持不变(Eq. 5-6)。此外,作者将催化剂的构型变为R-构型,产物的构型也随之变为相反构型,这说明产物的构型是由催化剂决定的(Eq. 7)。这些结果表明该反应不经历SN2'过程和动力学拆分过程。(图片来源:Angew. Chem. Int. Ed.)根据实验结果,作者推测可能的反应机理(Scheme 5)。首先,在手性磷酸作用下,炔丙醇发生脱水过程转化为离子对IM-a,IM-a可异构化为手性磷酸活化的亚胺亚甲基中间体IM-b。接着,亲核试剂进攻炔丙醇的炔基会形成两种过渡态TS-E和TS-Z。在过渡态TS-Z中,亲核试剂进攻炔基的方向与氢键方向保持一致,而在过渡态TS-E中则正好相反,而经历TS-E过渡态生成的E-构型产物又会转化为中间体IM-a。因此,该反应最后是经历TS-Z过渡态转化为Z-构型产物。(图片来源:Angew. Chem. Int. Ed.)最后,作者对反应进行了动力学研究。随着亲核试剂用量的增加,反应速率不发生变化(Figure 2a)。这表明亲核试剂进攻这一步不是决速步骤。同时,产物的ee值和催化剂的ee值呈线性关系(Figure 2b)。这表明只有一个催化剂分子参与该反应,从而排除了多个催化剂同时参与反应的可能。 (图片来源:Angew. Chem. Int. Ed.)
总结:香港科技大学孙建伟课题组报道了手性磷酸催化吲哚取代的炔丙醇与3-苯基吲哚或1-萘酚的不对称1,8-共轭加成反应,能以良好至优秀的收率及对映选择性得到一系列四取代联烯化合物。同时,对照实验的结果表明远程控制的1,8-共轭加成反应中涉及的原位生成的吲哚亚甲基亚胺类化合物是通过双功能过渡态转化而来的。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn