- 首页
- 资讯
福建物质结构研究所李纲课题组JACS:光催化还原芳基卤代物实现苯乙烯羧基芳基双官能团化
来源:化学加编辑部 陈十五 2020-05-18
导读:近日,福建物质结构研究所李纲课题组报道了首例具有区域选择性,由可见光驱动的,芳基卤化物与二氧化碳对苯乙烯的还原性羧基芳基双官能团化反应。该反应不仅适用于广泛的芳基碘化物和溴化物、吡啶基卤化物、烷基卤化物,甚至还适用于芳基氯化物,文章DOI:10.1021/jacs.0c03144。
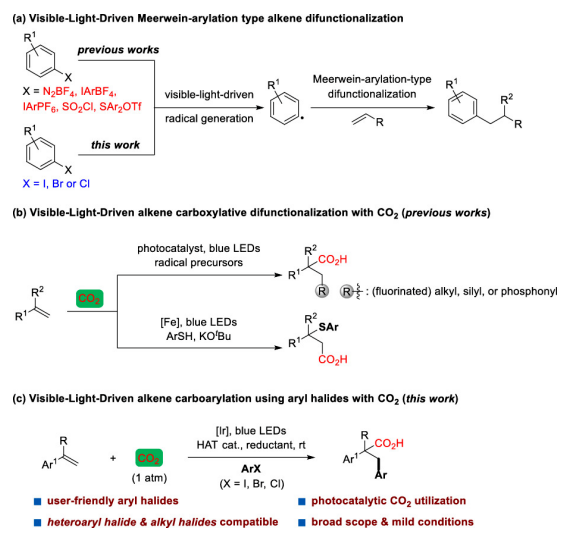
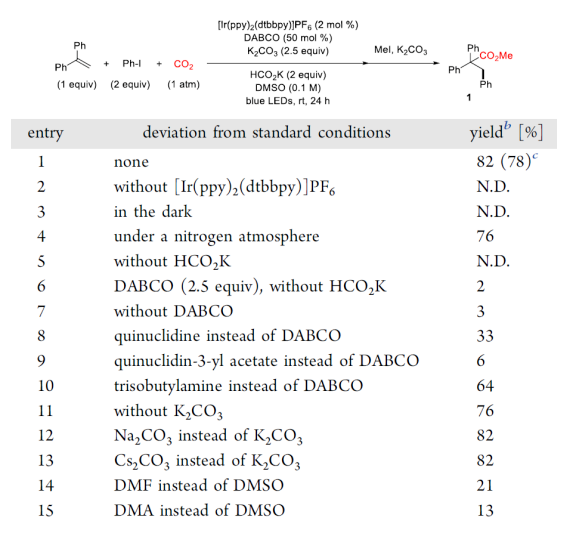
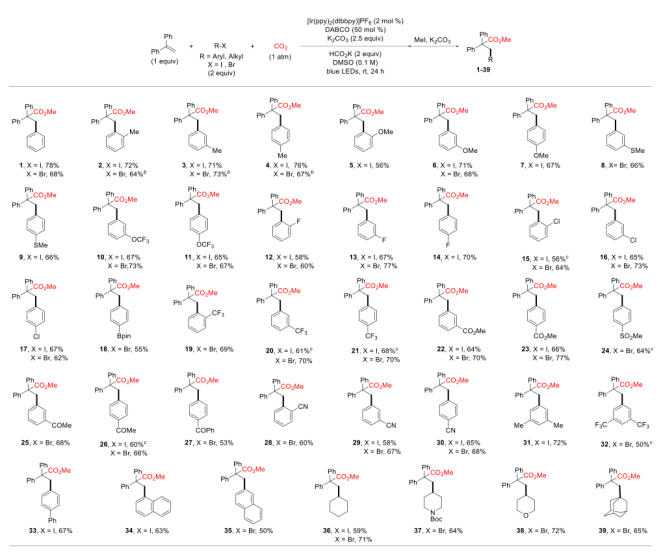
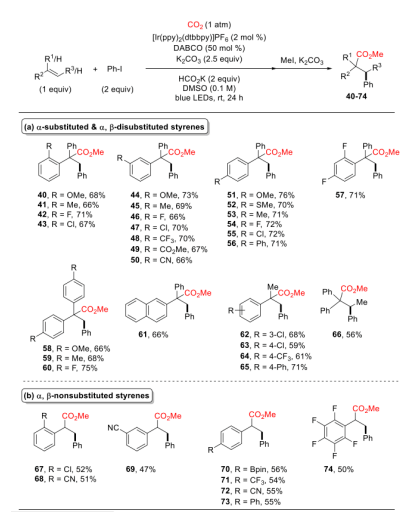
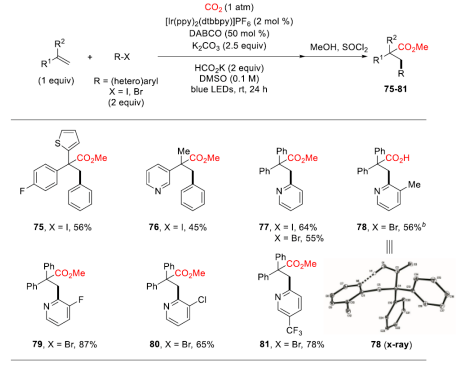
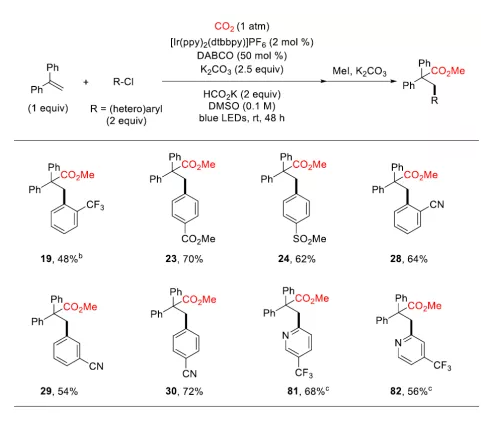
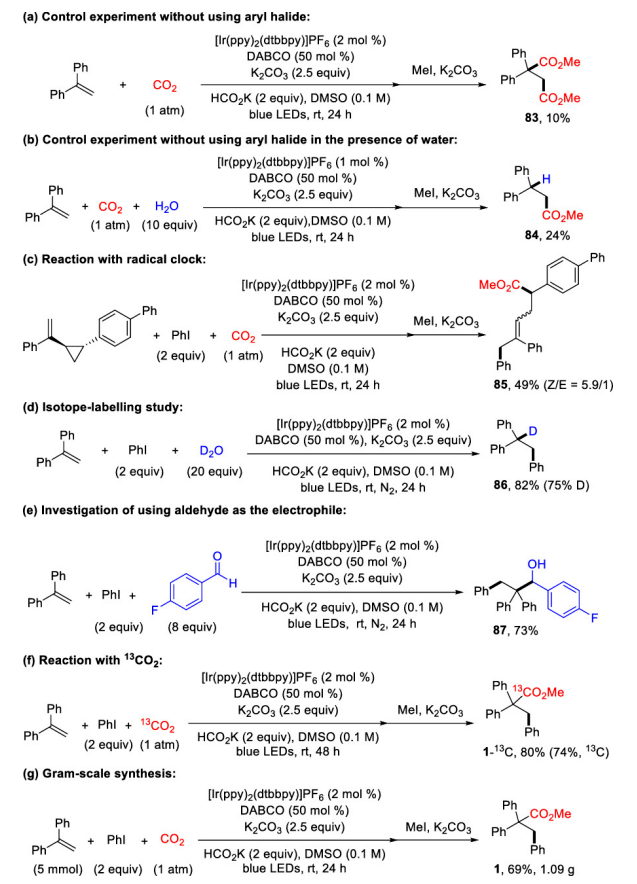
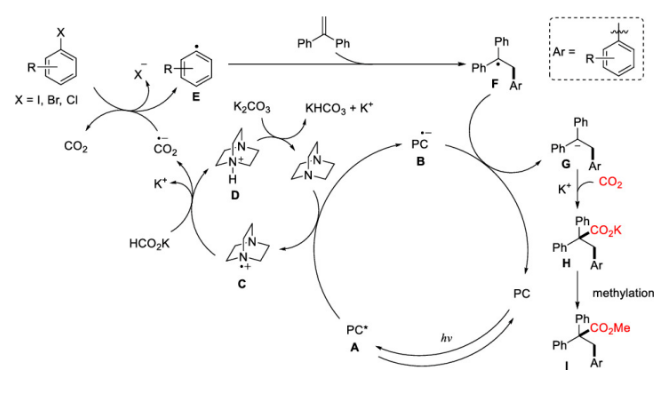
可见光驱动的光氧化还原催化(PRC)是在温和的反应条件下合成复杂有机分子的有效方法。基于König的开创性工作,以芳基重氮盐、二芳基碘鎓盐、芳基磺酰氯等化合物为芳基自由基来源,通过可见光驱动的Meerwein芳基化双官能化反应受到了人们广泛关注(图 1a)。然而相较于芳基重氮盐、二芳基碘鎓或芳基磺酰氯,芳基卤化物有更低的还原电势,因此在可见光条件下,由芳基卤化物获得高度反应活性的芳基自由基参与上述反应尚有极大的挑战。另一方面,二氧化碳(CO2)的光催化利用一直是精细化学品合成领域的研究热点,其不仅是理想的一碳(C1)合成子并且具有可持续、储量丰富、成本低廉、无毒等优点。此外,CO2参与的氧化还原中性的光催化烯烃双官能化反应可以快速合成大量含羧酸基团的生物活性分子(图1b)。但是,这种氧化还原中性的策略并不适用于烯烃与CO2和芳基卤代物的三组分反应,因为该反应涉及到芳基卤代物底物的还原。由于这一挑战,基于PRC策略的可见光驱动的烯烃与CO2的羧化芳基化反应尚未实现。受König,Stephenson,Jui等人研究工作启发,作者以广泛易得、廉价的HCO2K为还原剂,实现了首例具有高度区域选择性的可见光驱动的二氧化碳和芳基卤化物对苯乙烯的还原性羧基化芳基化双官能团反应,该反应能快速合成高价值的肉桂酸类衍生物(图1c)。 图1. 可见光驱动的烯烃双官能团化(图片来源:J. Am. Chem. Soc.)首先,作者以30 W蓝色LED灯为光源,[Ir(ppy)2(dtbbpy)]PF6为光敏剂,在室温下,一个大气压的二氧化碳氛围中,选择1,1-二苯乙烯、碘苯作为模型底物开始研究反应(图2)。经过对反应条件的深入研究,作者发现添加氢转移催化剂1,4-二氮杂双环[2.2.2]辛烷(DABCO),使用HCO2K作为还原剂,以K2CO3作碱,以二甲基亚砜(DMSO)为溶剂时,该反应以78%的分离收率得到目标产物(entry 1)。在没有光催化剂或光的情况下,无法检测到产物生成,表明了这是光驱动反应(entry 2和3)。研究表明HCO2K/DABCO的组合可能是该反应的有效电子供体。 图2. 反应条件的优化(图片来源:J. Am. Chem. Soc.)有了最优反应条件,作者对该反应的底物适用性进行了考察(图3)。首先作者发现多种给电子取代基和吸电子基团均能适用于该转化,并无太大差异(图3,化合物2-33)。此外不仅二级烷基卤化物,碘代萘,溴代萘均能参与反应,带有氯或硼酸酯基团的芳基碘化物或者溴化物对于该转化也能兼容(图3,化合物15-18),这为进一步衍生化提供了可能。图3. 芳基卤化物和烷基卤化物的底物适用性研究(图片来源:J. Am. Chem. Soc.)作者随后研究了苯乙烯底物适用范围(图4)。芳环上取代基的电性和取代基的位置对α-取代苯乙烯影响很小,均能高效参与反应,给出优异的产率,而较大位阻的α,β-二取代苯乙烯(图4,化合物66)只能得到中等收率。 图4. 苯乙烯的底物适用性研究(图片来源:J. Am. Chem. Soc.)根据这些结果,作者进一步测试了杂环底物,尤其是缺电子的吡啶卤化物。如图5所示,α-硫代呋喃基或吡啶基苯乙烯以中等收率得到目标产物(75和76)。更重要的是,该反应对于不同取代的吡啶基团均有良好的兼容性,大大拓展了它的实际应用空间。图5. 杂环底物适用性研究(图片来源:J. Am. Chem. Soc.)为了证明该反应的潜力,作者还测试了活性较低的芳基氯化物在可见光驱动的光催化反应中的表现(图6)。对于一些缺电子的芳基氯代物,该反应仍然可以给出较好的收率,这将有利于降低实际成本。 图6. 芳基氯化物底物适用性研究(图片来源:J. Am. Chem. Soc.)在测试完该反应的底物适用性之后,作者紧接着研究了反应机理。荧光淬灭实验证实了激发态的铱催化剂由DABCO淬灭。控制实验中,当不使用卤代芳烃则得到单一的羧化产物83和84,这表明CO2在反应条件下可能产生了阴离子自由基(图7a,b)。开环产物85则表明该反应可能有苄基自由基物种产生(图7c)。同位素标记实验与使用对氟苯乙醛作为亲电试剂(图7d,e)实验间接证明苄基阴离子中间体的存在。 图7. 机理研究以及放大反应(图片来源:J. Am. Chem. Soc.)在之前的实验基础上,作者提出了可能的反应机理(图8)。在蓝光照射下,铱催化剂被激发为激发态光敏剂,进而被DABCO还原淬灭得到还原态光敏剂B和DABCO自由基阳离子C。自由基C攫取HCO2K中的氢原子产生CO2自由基阴离子和阳离子D。CO2自由基阴离子具有足够的高还原电位,因此芳烃卤化物可以被二氧化碳自由基阴离子还原产生芳基自由基E,随即于与烯烃发生区域选择性加成得到苄位自由基F。新生成的自由基则被还原态光敏剂B还原生成苄基阴离子中间体G。然后G与二氧化碳发生亲核加成反应生成羧酸盐H,最后酯化得到目标产物。但是,作者也明确指出,苄位自由基F可能会先于CO2发生自由基加成,然后通过单电子转移被还原态光敏剂B还原最终得到目标产物。图8. 可能的反应机理(图片来源:J. Am. Chem. Soc.)总结:李纲研究员课题组开发展了首例可见光驱动的高效区域选择性的苯乙烯与二氧化碳和芳基卤化物的羧基芳基双官能团化反应,这种强还原性策略兼容了大量的芳基卤化物,包括缺电子芳烃,吡啶基卤化物,烷基卤化物和廉价的芳基氯化物,这将为新的二氧化碳光催化利用反应提供新的研究思路。
撰稿人:陈十五
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn