- 首页
- 资讯
复旦麻生明院士/张俊良教授团队JACS:Pd-催化芳基三氟甲磺酸酯和炔烃之间的对映选择性Heck反应
来源:化学加(ID:tryingchem) 2019-12-06
导读:复旦大学麻生明院士/张俊良教授团队近日首次报道了钯催化的芳基三氟甲磺酸酯与炔烃之间不对称Heck反应,该成果发表于近期J. Am. Chem. Soc.(DOI: 10.1021/jacs.9b10883)。
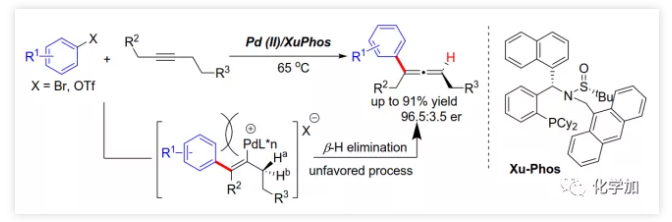
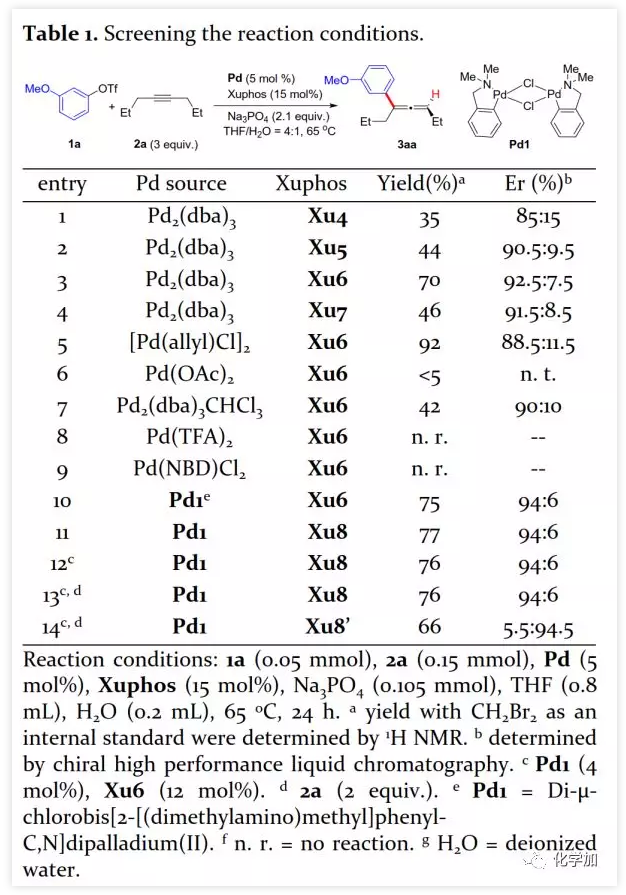
具有轴手性的联烯片段存在于多种活性天然产物和药物中。由于其具有独特的反应性及其取代基的电性和空间效应,作为合成中间体可通过环加成、亲核加成、氧化、交叉偶联、环异构化等得到广泛应用。通过将轴手性转移至中心手性,可以获得其他方法难以合成的手性分子。鉴于手性联烯在有机合成中的重要性,构建手性联烯的方法受到了广泛关注。目前,已开发了多种构建手性三取代联烯的策略,包括动力学拆分、手性转移、去对称化、不对称重氮偶联、异构化、不对称Wittig反应、共轭烯炔以及炔丙基衍生物的不对称羧化、不对称环加成和环丙烯酮衍生物的不对称转化等。另一方面,通过烯烃的Heck反应构建C-C键是有机合成中最常见的方法。然而,由于乙烯基钯的β-H消除在能量上不利,使得通过炔烃的Heck反应合成联烯的方法滞后。1989年,Heck课题组首次在3-己炔和2-碘代苯甲酸甲酯的反应副产物中观察到三取代联烯(Scheme 1a)。随后,Miura课题组利用邻位取代的芳基溴在相关条件下进行了选择性反应,可能由于邻位取代的芳基与乙烯基钯的PdLn之间空间位阻的增加在能量上有利于β-H消除。Hamblett课题组开发了一种芳基氯与炔烃的分子内Heck环化反应通过配体转换选择性地合成联烯或共轭二烯。2014年,Larini、Jazzar等人利用新的配体(DFOTP)借助碱的去质子化而非Heck型钯催化的β-H消除实现了芳基溴化物和炔烃之间的偶联得到联烯。2018年,Frantz课题组报道了水溶性dba配体/Pd(0)催化的芳基三氟甲磺酸酯和炔烃之间的Heck反应,可以在温和条件下得到三取代联烯。2019年,程国林课题组首次报道了邻位取代的芳基碘化物与1-芳基-1-炔烃之间的区域选择性碳钯化。然而,当用dArFpe作为配体时,Morandi发现炔烃发生碘代而非Heck反应。时至今日,由于缺乏合适的手性配体来促进不利的β-H消除以及控制对映选择性,钯催化的芳基三氟甲磺酸酯和炔烃之间的对映选择性Heck型反应尚未报道。最近,张俊良教授课题组开发的一系列含柔性亚磺酰胺片段的新型手性膦配体(即Sadphos)在钯催化的不对称交叉偶联反应、还原性Heck反应及相关串联反应中表现出了良好的性能。为了进一步拓展这些新手性配体的应用,作者尝试将其用于芳基卤化物或三氟甲磺酸酯与炔烃的不对称Heck反应,但存在以下挑战:1)如何控制产物比例(Heck反应产物与碘代产物);2)通过乙烯基钯的β-H消除生成乙炔在能量上是不利的,寻求合适的手性配体以获得良好的收率和高对映选择性将充满挑战;3)联烯产物易发生异构化形成1,3-二烯产物;4)联烯产物与有机卤化物或三氟甲磺酸酯进一步发生Heck反应。结合文献报道,复旦大学麻生明院士/张俊良教授团队认为配体是解决上述问题的关键,该团队近日首次报道了钯催化的芳基三氟甲磺酸酯与炔烃之间不对称Heck反应。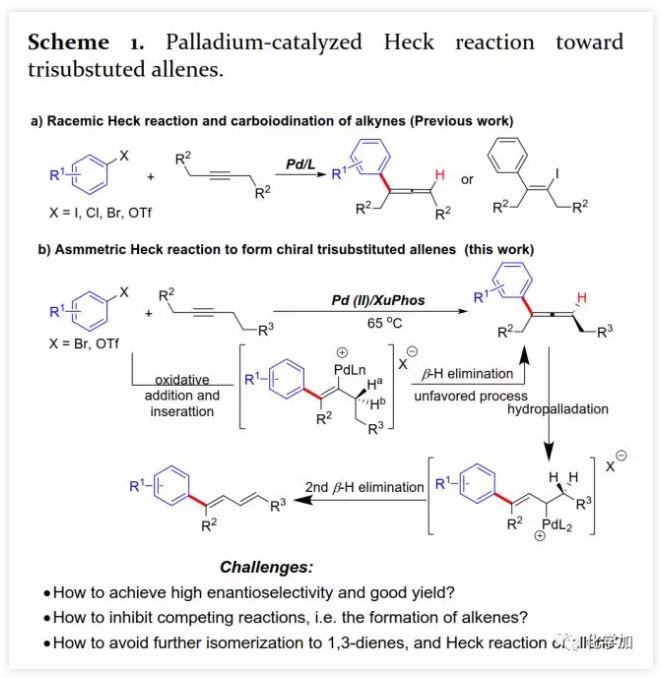 首先,作者以芳基三氟甲磺酸酯1a与炔烃2a之间的不对称Heck反应作为模型反应对反应条件进行了筛选(Figure 1和Table 1)。作者考察了多个商业来源的手性配体如L1~L6均未能促进反应,筛选了一系列Sadphos配体如含有游离NH部分的Ming-Phos、Xiang-Phos、Wei-Phos和Xu-Phos也未能得到产物。受Frantz工作的启发,作者认为增加配体的空间位阻可能促进乙烯基钯的β-H消除。实际上,在磺酰胺部分引入甲基得到的Xu-Phos(Xu2和Xu3)可以催化该反应,收率为30-38%且具有中等对映选择性(Figure 1)。因此,作者制备了一些含不同N-取代基的新Xu-Phos Xu4-Xu8(Table 1),发现Xu-Phos分子中氮原子上的保护基对对映选择性和反应性有很大影响,其中较大的取代基反应性更好。最后,作者确定了以下最佳反应条件:以Pd2(dba)3为预催化剂、Xu6为手性配体、Na3PO4为碱,在65 ℃ THF/H2O中可以70%的收率得到3aa(92.5:7.5 er)。当用[Pd(allyl)Cl]2作为催化剂时,可以92%的收率得到3aa,但对映选择性相对较低(88.5:11.5 er);当以Pd1为预催化剂时,可以73%的收率制备3aa(94:6 er);其他钯催化剂产生的对映选择性和收率较低,其中Pd(II)前体优于Pd(0);当用Xu8为配体时,得到的结果类似。将催化剂的负载量降至4 mol%时,得到的结果相同;将2a的用量减少至2 eq.时,也可以74%的收得到3aa(94:6 er)。此外,当以相应的对映体Xu8'为手性配体时,得到3aa的er值为5.5:94.5,即3aa的对映体是主要产物。
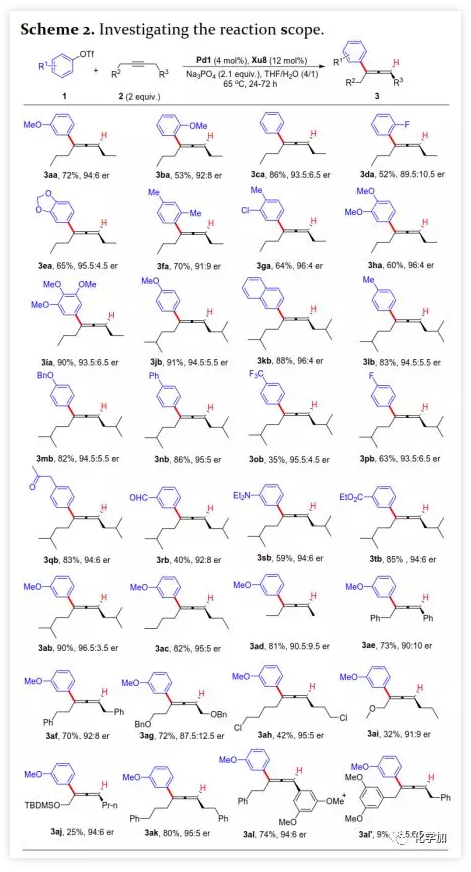
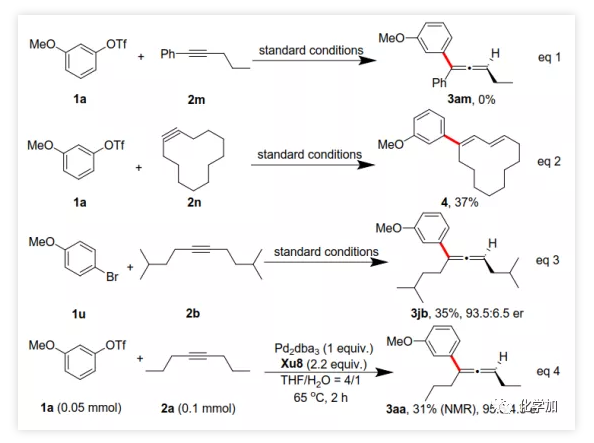
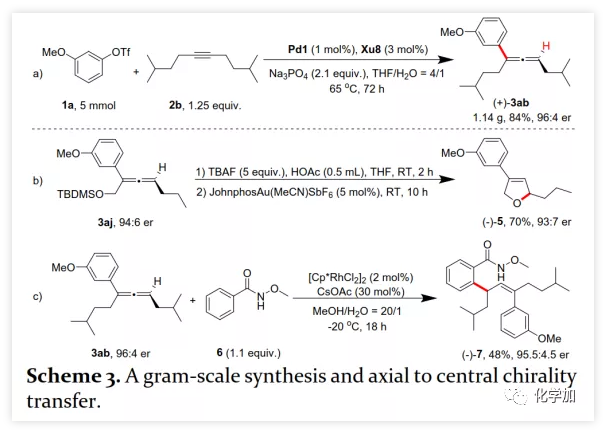
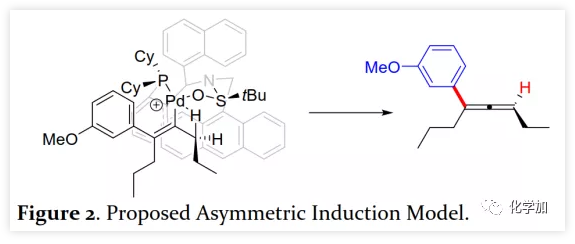
首先,作者以芳基三氟甲磺酸酯1a与炔烃2a之间的不对称Heck反应作为模型反应对反应条件进行了筛选(Figure 1和Table 1)。作者考察了多个商业来源的手性配体如L1~L6均未能促进反应,筛选了一系列Sadphos配体如含有游离NH部分的Ming-Phos、Xiang-Phos、Wei-Phos和Xu-Phos也未能得到产物。受Frantz工作的启发,作者认为增加配体的空间位阻可能促进乙烯基钯的β-H消除。实际上,在磺酰胺部分引入甲基得到的Xu-Phos(Xu2和Xu3)可以催化该反应,收率为30-38%且具有中等对映选择性(Figure 1)。因此,作者制备了一些含不同N-取代基的新Xu-Phos Xu4-Xu8(Table 1),发现Xu-Phos分子中氮原子上的保护基对对映选择性和反应性有很大影响,其中较大的取代基反应性更好。最后,作者确定了以下最佳反应条件:以Pd2(dba)3为预催化剂、Xu6为手性配体、Na3PO4为碱,在65 ℃ THF/H2O中可以70%的收率得到3aa(92.5:7.5 er)。当用[Pd(allyl)Cl]2作为催化剂时,可以92%的收率得到3aa,但对映选择性相对较低(88.5:11.5 er);当以Pd1为预催化剂时,可以73%的收率制备3aa(94:6 er);其他钯催化剂产生的对映选择性和收率较低,其中Pd(II)前体优于Pd(0);当用Xu8为配体时,得到的结果类似。将催化剂的负载量降至4 mol%时,得到的结果相同;将2a的用量减少至2 eq.时,也可以74%的收得到3aa(94:6 er)。此外,当以相应的对映体Xu8'为手性配体时,得到3aa的er值为5.5:94.5,即3aa的对映体是主要产物。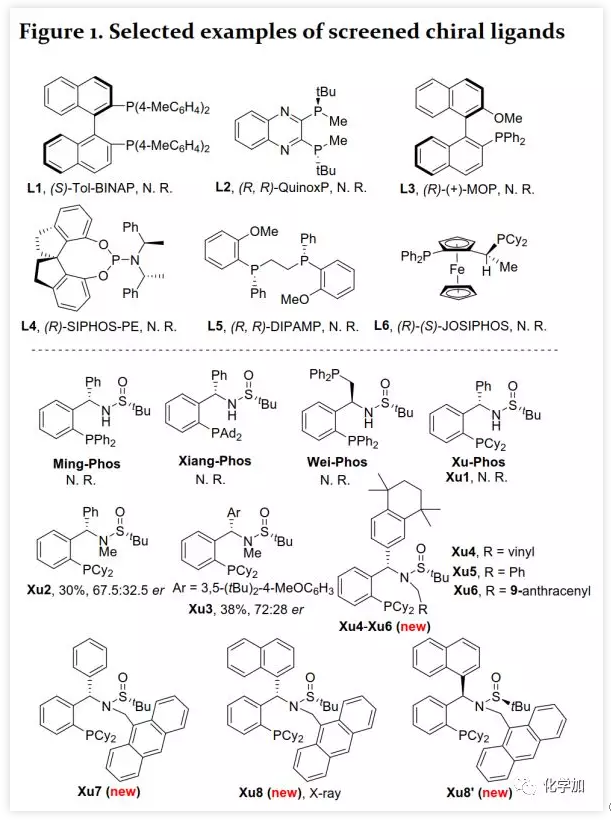 在确定最佳反应条件后,作者考察了各种芳基三氟甲磺酸酯和炔烃(Scheme 2)。在标准条件下,含吸电子基和给电子基的芳基三氟甲磺酸酯均可以良好的对映选择性得到相应产物,而含吸电子基的缺电子芳基三氟甲磺酸酯则表现出较低的反应性(Table 2)。间位和对位取代的芳基三氟甲磺酸酯反应相似,但邻位取代的芳基三氟甲磺酸酯需要更长的反应时间且对映选择性相对较低,Xu6的性能优于Xu8。在反应条件下,含有酯、醛、酮和N-原子保护的氨基等官能团的底物均可以耐受,为进一步修饰提供了位点。由于在消除过程中氧原子与金属中心配位的缘故,含有醚结构的炔烃的对映选择性较低。此外,非对称炔烃通过不同的区域选择性Heck反应得到两种产物(3al,3al'),但由于反区域选择性Heck反应产生不稳定的联烯基醚,只以低收率分离得到单一产物(3ai,3aj)。最后,通过联烯3ca的比旋光度与文献数据比较,将产物的绝对构型定为S。此外,作者在1-芳基-1-烷基炔烃的反应中未得到联烯产物(eq 1);对于环状炔烃,只得到环状共轭二烯而非联烯,这表明环状联烯产物在反应条件下易进一步异构化(eq 2)。作者还考察了芳基溴和芳基碘底物,其中芳基溴1u与2b的反应可以35%的收率得到联烯产物(93.5:6.5 er)。为了研究其反应机理,在不加Na3PO4的情况下,作者用化学计量的催化剂将1a和2a反应,并以31% NMR的收率得到3aa,这排除了借助碱的不对称去质子化途径的可能性(eq 4)。 最后,作者进行了1a和2b之间的克级规模反应并以84%的收率得到4a(96:4 er)(Scheme 3,a);含硅醚保护基的手性三取代联烯3aj经脱保护后,在金催化剂的催化下环化得到手性2,5-二氢呋喃5(93:7 er)(Scheme 3,b);Rh(III)-催化的N-甲氧基苯甲酰胺6与手性三取代联烯3ab的逐步邻位烯丙基化得到产物7(95.5:4.5 er)(Scheme 3,c)。根据手性配体Xu8的结构、Sadphos与钯的络合方式和产物S-3aa的绝对构型,作者提出了手性诱导模型(Figure 2)。小结:复旦大学麻生明院士/张俊良教授团队开发了一种钯催化的芳基三氟甲磺酸酯和炔烃之间的不对称Heck反应,通过含较大位阻N-取代基的Xu-Phos的利用使在能量上不具优势的乙烯基钯的β-H消除得以顺利进行。该反应在温和条件下可以中等至高收率得到含各种官能团的手性三取代联烯,其er值最高可达96.5: 3.5。此外,通过将轴手性转移至中心手性,可以为构建分子的手性提供不可替代的方法。
在确定最佳反应条件后,作者考察了各种芳基三氟甲磺酸酯和炔烃(Scheme 2)。在标准条件下,含吸电子基和给电子基的芳基三氟甲磺酸酯均可以良好的对映选择性得到相应产物,而含吸电子基的缺电子芳基三氟甲磺酸酯则表现出较低的反应性(Table 2)。间位和对位取代的芳基三氟甲磺酸酯反应相似,但邻位取代的芳基三氟甲磺酸酯需要更长的反应时间且对映选择性相对较低,Xu6的性能优于Xu8。在反应条件下,含有酯、醛、酮和N-原子保护的氨基等官能团的底物均可以耐受,为进一步修饰提供了位点。由于在消除过程中氧原子与金属中心配位的缘故,含有醚结构的炔烃的对映选择性较低。此外,非对称炔烃通过不同的区域选择性Heck反应得到两种产物(3al,3al'),但由于反区域选择性Heck反应产生不稳定的联烯基醚,只以低收率分离得到单一产物(3ai,3aj)。最后,通过联烯3ca的比旋光度与文献数据比较,将产物的绝对构型定为S。此外,作者在1-芳基-1-烷基炔烃的反应中未得到联烯产物(eq 1);对于环状炔烃,只得到环状共轭二烯而非联烯,这表明环状联烯产物在反应条件下易进一步异构化(eq 2)。作者还考察了芳基溴和芳基碘底物,其中芳基溴1u与2b的反应可以35%的收率得到联烯产物(93.5:6.5 er)。为了研究其反应机理,在不加Na3PO4的情况下,作者用化学计量的催化剂将1a和2a反应,并以31% NMR的收率得到3aa,这排除了借助碱的不对称去质子化途径的可能性(eq 4)。 最后,作者进行了1a和2b之间的克级规模反应并以84%的收率得到4a(96:4 er)(Scheme 3,a);含硅醚保护基的手性三取代联烯3aj经脱保护后,在金催化剂的催化下环化得到手性2,5-二氢呋喃5(93:7 er)(Scheme 3,b);Rh(III)-催化的N-甲氧基苯甲酰胺6与手性三取代联烯3ab的逐步邻位烯丙基化得到产物7(95.5:4.5 er)(Scheme 3,c)。根据手性配体Xu8的结构、Sadphos与钯的络合方式和产物S-3aa的绝对构型,作者提出了手性诱导模型(Figure 2)。小结:复旦大学麻生明院士/张俊良教授团队开发了一种钯催化的芳基三氟甲磺酸酯和炔烃之间的不对称Heck反应,通过含较大位阻N-取代基的Xu-Phos的利用使在能量上不具优势的乙烯基钯的β-H消除得以顺利进行。该反应在温和条件下可以中等至高收率得到含各种官能团的手性三取代联烯,其er值最高可达96.5: 3.5。此外,通过将轴手性转移至中心手性,可以为构建分子的手性提供不可替代的方法。
撰稿人:爽爽的朝阳
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn