

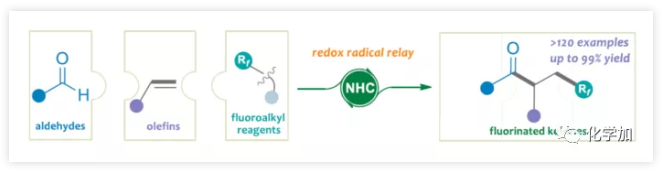
(图片来源:Angew. Chem. Int. Ed.)
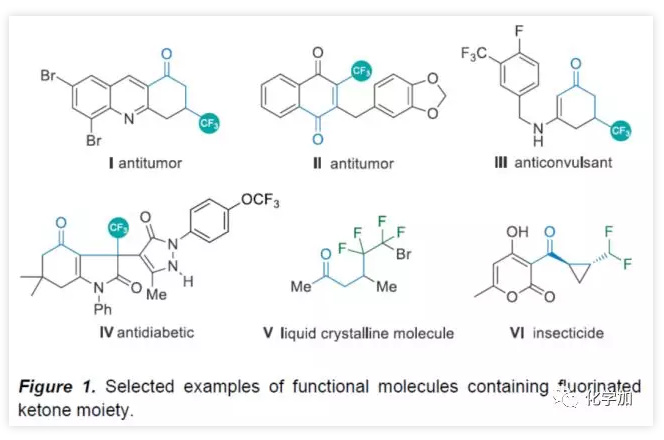
氟化物广泛应用于药物化学、农作物保护和材料科学领域,而将氟原子引入分子中,通常会对分子的渗透性、亲脂性和代谢稳定性产生积极的影响。因此,合成各类含氟化合物已引起学术界和工业界的关注。氟代酮化合物作为候选药物和功能材料中最受欢迎的结构之一(Figure 1)。例如,β-三氟甲基化酮(I−IV)可用于治疗结肠癌、肺癌,同时还可作为抗惊厥药和抗糖尿病药。γ-二氟代酮V被用作液晶材料,VI具有出色的杀虫活性。因此,开发高效实用方法合成氟代酮化合物具有重要意义。
(图片来源:Angew. Chem. Int. Ed.)
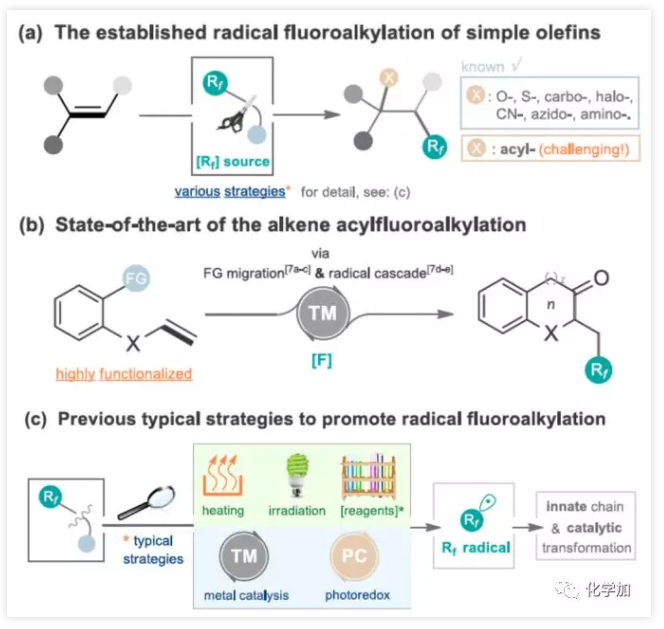
简单烯烃的自由基氟代烷基化反应(烯烃双键同时引入氟和其他官能团)作为合成复杂氟化分子高效方法。大量的烯烃双官能化已经取得了重大进展(包括碳、氧、卤、硫、氰基、叠氮基和氨基氟烷基化)。相比之下,通过简单烯烃的自由基酰基氟烷基化直接合成氟代酮化合物具有挑战性,并且开发不足(Figure 2a)。尽管自由基参与官能团迁移或分子内自由基偶联反应已取得成功,但这些方法通常是由过渡金属引起的,同时需要多步制备含羰基的烯烃底物(Figure 2b)。此外,一些促进氟代烷基化反应条件仍然存在一定的局限性,如加热、紫外线照射、添加化学引发剂或氧化剂、过渡金属催化等(Figure 2c)。因此,通过简单烯烃经自由基催化体系实现酰基氟烷基化反应有待开发。
(图片来源:Angew. Chem. Int. Ed.)
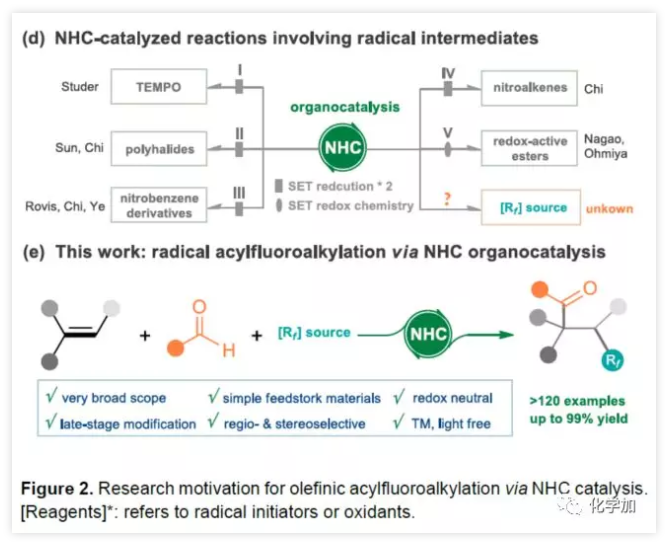
由于N-杂环卡宾(NHC)催化剂具有极性反转的特性,可在离子化学中进行各种酰化反应。同时,一些课题组已公开了NHC参与的自由基反应,涉及连续两次单电子还原的过程(Figure 2d)。最近,Nagao报告了醛与具有氧化还原活性酯经NHC催化实现自由基脱羧偶联。在该反应中,去质子化的Breslow中间体(BI)可用作单电子还原剂,还原具有氧化还原活性的酯,并且可以将生成的烷基中间体与BI中间体重组,以产生交叉偶联产物。考虑到这种情况,作者推测NHC参与单电子转移(SET)也可能适用于各种氟代烷基,例如Togni试剂(产生自由基Rf),可能引起烯烃自由基加成,然后进行自由基与自由基的偶联,从而实现简单烯烃的自由基酰基氟烷基化反应(Figure 2e)。该方案具有广泛的底物范围、易于获得的原料、优异的区域和非对映选择性、无金属自由基催化等优点。
(图片来源:Angew. Chem. Int. Ed.)
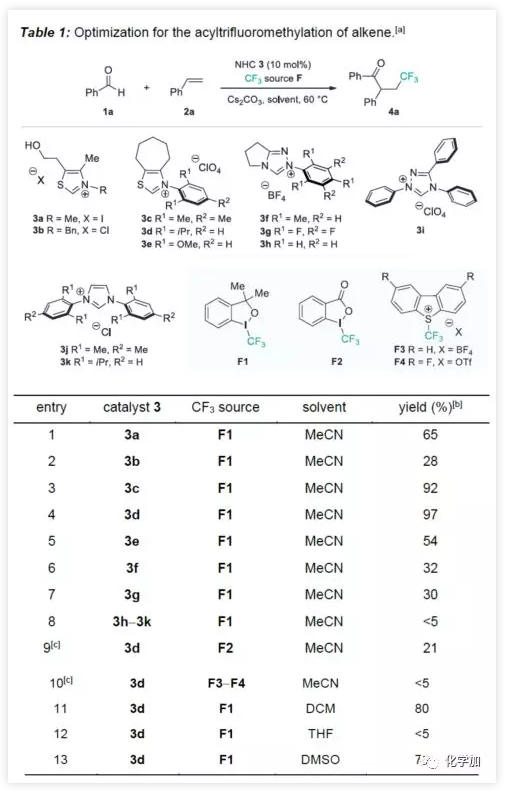
首先,作者以苯甲醛1a、苯乙烯2a和Togni I试剂F1作为模型底物进行了条件筛选(Table 1)。通过NHC催化剂的筛选(entries 1−8),NHC催化剂3d可获得收率97%的4a,其他催化剂可能是由于催化效率低或者无法促进目标自由基的转化导致收率偏低。而对其它CF3源(entries 9−10)和溶剂的筛选中(entries 11−13),收率均没有提高。
(图片来源:Angew. Chem. Int. Ed.)
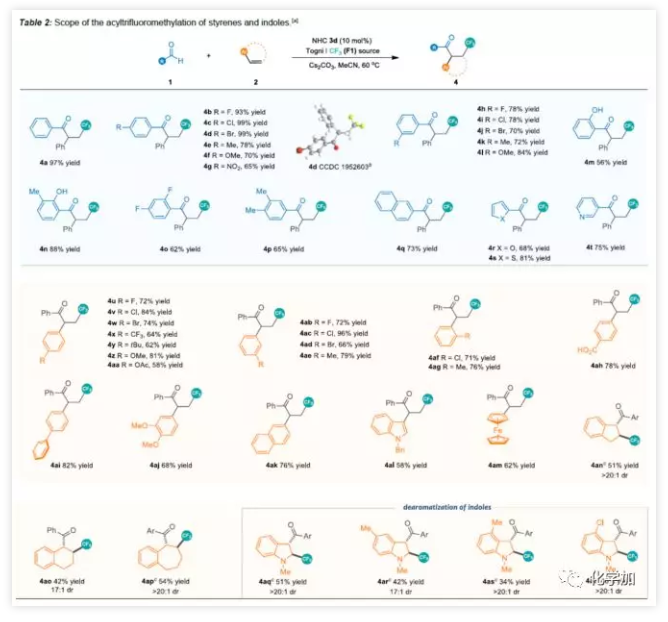
在获得上述最佳反应条件后,作者开始对底物进行了扩展(Table 2)。首先,以芳香醛1和苯乙烯2进行底物扩展。通过实验,作者发现电子效应和定位效应对反应影响不大,均可获得产率较高的氟代酮化合物(4a-4p),萘基和各种杂芳基醛(4q-4t)同样适用于此体系。随后,作者以苯甲醛与多种烯烃2进行相关验证。在对位、间位和邻位在苯环上同时带有吸电子和给电子取代基的苯乙烯都可以参与该反应,获得高收率的产物(4u-4aj)。值得注意的是,游离的羧基也与该反应相容,并以78%的产率获得了相应的4ah。萘基、吲哚基或二茂铁基取代的苯乙烯也能够顺利进行获得相应的氟代酮(4ak-4am)。一些环状烯烃,同时表现出有良好的非对映选择性(4an-4ap)。此外,可以实现N-甲基吲哚的去芳化反应获得三氟甲基化吲哚基酮(4aq-4at)。
(图片来源:Angew. Chem. Int. Ed.)
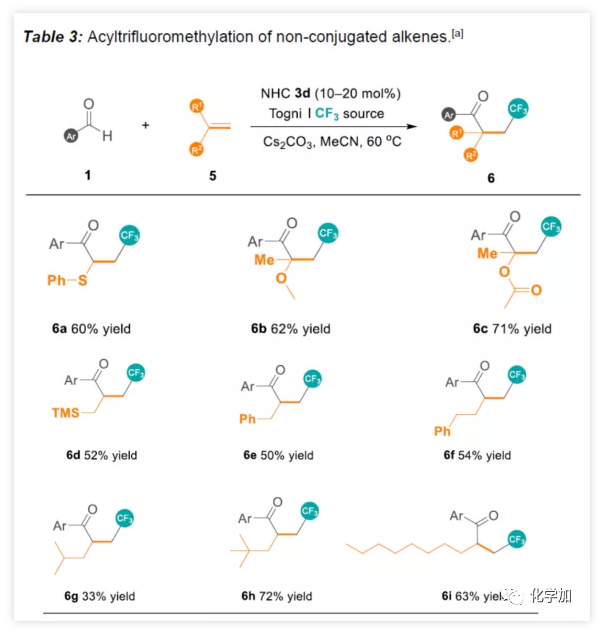
紧接着,作者开始尝试苯甲醛与非共轭烯烃反应(Table 3)。苯基乙烯基硫醚能够顺利反应获得60%收率的6a。1,1-二取代的乙烯基醚和乙烯基酯,可获得四级立体中心的酮6b-6c。令人欣慰的是,一些未活化烯烃(6d-6f)和未官能化的末端烯烃(6g-6i)同样可以获得相应的产物。
(图片来源:Angew. Chem. Int. Ed.)
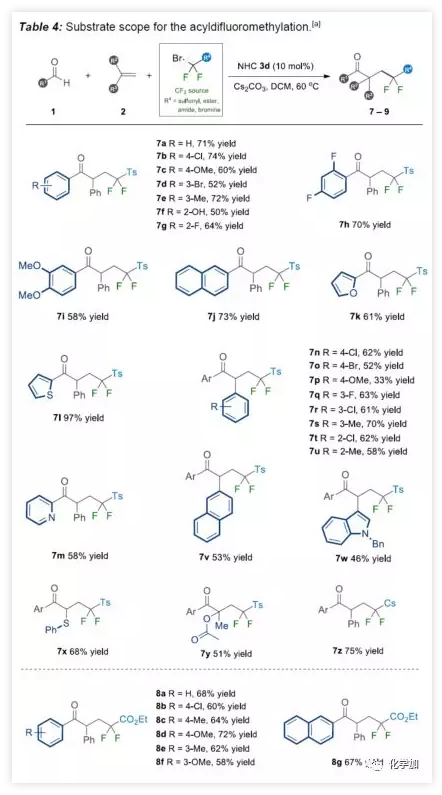
由于二氟化合物在现代有机氟化学中也起着重要作用,作者希望扩展NHC有机催化策略,实现烯烃的自由基酰基二氟烷基化反应。在上述催化条件下,对甲苯磺酰基(Ts)取代的溴代二氟甲基容易地与各种芳香醛和烯烃一起参与反应(Table 4)。底物扩展与上述结果基本一致。此外,廉价的二溴二氟甲烷可直接用作该NHC有机催化系统中获得相应的γ-三卤代酮衍生物(9a-9b)。
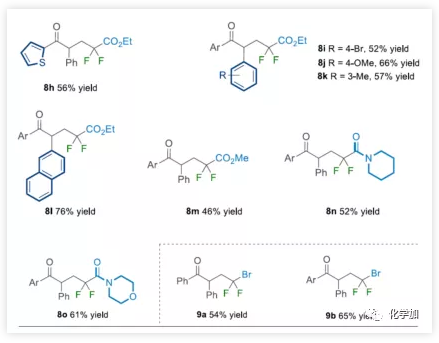
(图片来源:Angew. Chem. Int. Ed.)
受烯烃二氟甲基化的影响,作者开始尝试NHC催化的自由基全氟烷基化反应(Table 5)。实验结果表明,具有不同长度的全氟烷基碘,通过上述方案可以轻松合成全氟酮10a-10d,产率56%-76%。
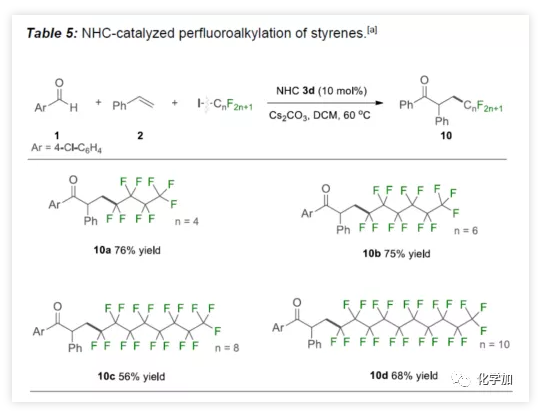
(图片来源:Angew. Chem. Int. Ed.)
为了进一步证明该方案的实用性,作者对一些药物骨架进行后期修饰(Table 6)。首先,非诺贝特(Fenofibrate)是临床上最常见的降血脂药物,通过上述方案,成功将酮和氟烷基引入非诺贝特中(11a−11f)。除了非手性药物修饰之外,该方法还可以以非对映性的方式对药物分子进行修饰。如雌酮(12)和生育酚衍生物(13)的酰基氟烷基化反应,两者均含有手性中心,且骨架上的几个化学键远离苯乙烯部分,反映结果均表现良好的立体选择性。三氟甲基化或二氟甲基化反应分别获得目标分子12a-12f和13a-13f(满足> 20:1的非对映选择性比率)。
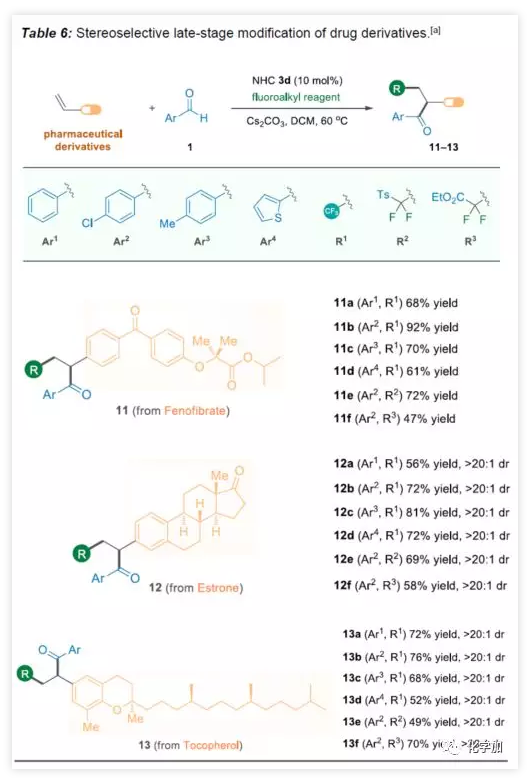
(图片来源:Angew. Chem. Int. Ed.)
根据相关的对照试验以及文献的查阅,作者提出了一种可能的反应机理(Figure 3)。NHC催化剂与醛在碱性条件下,去质子化形成Breslow中间体I。然后,富电子I对氟代烷基试剂(Rf-X)进行单电子还原,生成了两个自由基中间体(A和B)。最后,氟代烷基A与苯乙烯2a加成产生苄基C,通过自由基交叉偶联(C与B的偶联)获得中间体II,随后释放NHC,产生氟代酮产物。
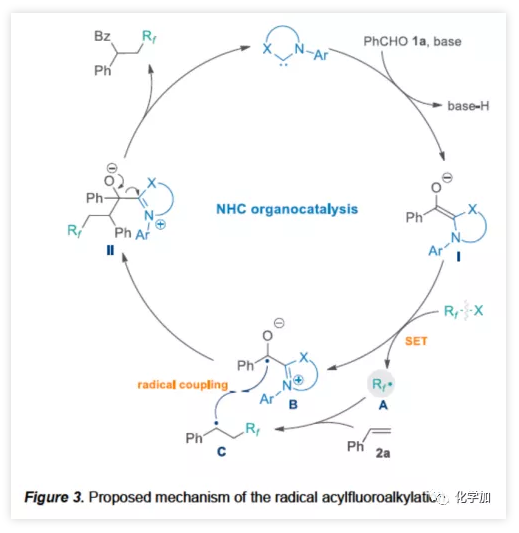
(图片来源:Angew. Chem. Int. Ed.)
撰稿人:杉杉
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn