


但是,这种“附带效应”并不是专门针对肿瘤细胞的,因为一旦任何细胞的RNA达到与Cas13a/crRNA复合物的互补结合,它就可以被激活。当全身施用基于CRISPR/Cas13a系统的药物时,可能会导致与肿瘤以外的组织中不希望的细胞死亡有关的安全性问题。因此,仅在肿瘤细胞中限制CRISPR / Cas13a系统激活的可行策略对于基于CRISPR/ Cas13a的药物在癌症治疗中的安全应用至关重要。
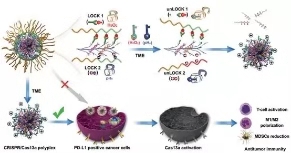
图1. DLNP用于有效癌症免疫治疗的示意图。类似于仅在两个锁都解锁时才能打开的双锁保险箱,DLNP只能在低pHe和高H2O2浓度同时存在的微环境中释放CRISPR /Cas13a系统。
近来,南开大学刘阳研究员和史林启教授团队联合天津医科大学康春生教授团队合作在Advanced materials上发表文章,提出了一种可以限制CRISPR/Cas13a激活至肿瘤组织的双锁纳米颗粒(DLNP)。DLNP具有核-壳结构。在血液循环或正常组织中,聚合物层赋予DLNP带负电荷的聚乙二醇化表面,可有效维持其循环稳定性。到达肿瘤微环境后,聚合物层降解为阳离子聚合物,从而促进CRISPR/Cas13a系统的细胞内在化和基因编辑的激活。类似于双锁保险箱,只有在低pHe和高H2O2浓度的微环境中,DLNP才能释放CRISPR/Cas13a系统。
在这项研究中,选择靶向PD-L1基因的crRNA作为模型crRNA。通过精准控制CRISPR/Cas13a激活,DLNP成功地在肿瘤中富集并诱导PD-L1阳性的肿瘤细胞死亡和免疫系统的活化。南开大学博士研究生张展展为本论文的第一作者,论文通讯作者为刘阳研究员、史林启教授和康春生教授。

图2. DLNP, H2O2-NP和pH-NP的结构表征
如图2a所示,双锁纳米粒子DLNP通过两步法制备完成,其中编码CRISPR/Cas13a系统的pDNA被负载在纳米粒子的核内,并由pH和H2O2双响应的聚合物壳层所包裹。研究人员通过zeta电位,表面非特意性蛋白吸附,荧光能量共振转移以及细胞摄取等实验,证明了双锁纳米粒子的pH和H2O2双特异性。
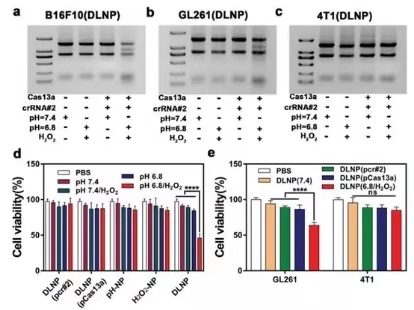
图3. DLNP, H2O2-NP和pH-NP的生物功能表征
研究人员随后选择针对PD-L1的crRNA作为模型RNA对DLNP, H2O2-NP和pH-NP的生物功能进行研究,如果3所示,经DLNP处理的B16F10(a)和GL261(b)细胞的核糖体RNA在pH 6.8/H2O2下显示出类似的裂解趋势,而在DLNP处理的4T1细胞(c)中未观察到RNA裂解。表明诱导RNA切割时DLNP的TME和PD-L1双重特异性。进一步的细胞活性实验也证实了这些结果。
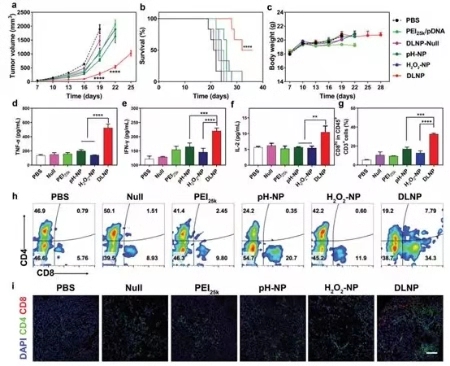
图4. DLNP, H2O2-NP和pH-NP体内抑瘤效果
随后,研究人员对三种纳米粒子的体内抑瘤效果进行了研究,如图4所示,相较于H2O2-NP和pH-NP,DLNP可以有效抑制肿瘤的生长,延长荷瘤小鼠的生存周期,提高TNF-α, IFN-γ和IL-2的表达量并可有效提高肿瘤内CD8+ T细胞的浸润。表明DLNP可以有效扰乱PD-1/PD-L1通路,并实现对T细胞介导的抑瘤活性的恢复。
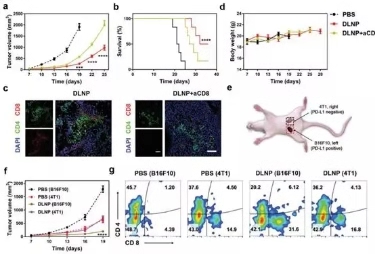
图5. DLNP在CD8+T细胞阻断模型和4T1 / B16F10共存模型中的体内抑瘤效果。
最后,研究人员利用aCD8a对小鼠体内的效应T细胞进行阻断来研究DLNP的体内作用机制,如图5a所示,在T细胞阻断的小鼠中,DLNP的抑瘤效果和对小鼠的生存周期影响大幅度下降,表明DLNP是通过对T细胞的激活来完成对肿瘤生长的抑制。随后,研究人员在4T1 / B16F10共存的小鼠中对DLNP的抑瘤效果进行分析,结果表明DLNP可以选择性杀伤高表达PD-L1的肿瘤细胞而对低表达的4T1则无明显效果。对CD8的分析数据同样表明该结果。
考虑到免疫效应细胞抑制途径的多样性,可以通过替换特异性crRNA的靶向基因而进行的进一步开发可能使DLNP成为快速开发安全有效的癌症免疫疗法的通用平台。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn