(图片来源:Angew. Chem. Int. Ed.)
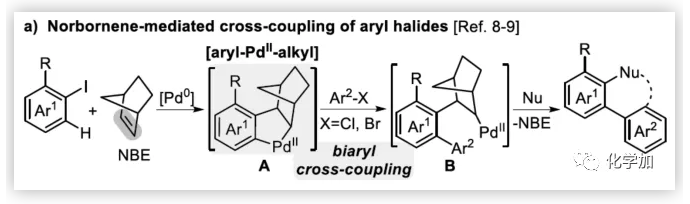
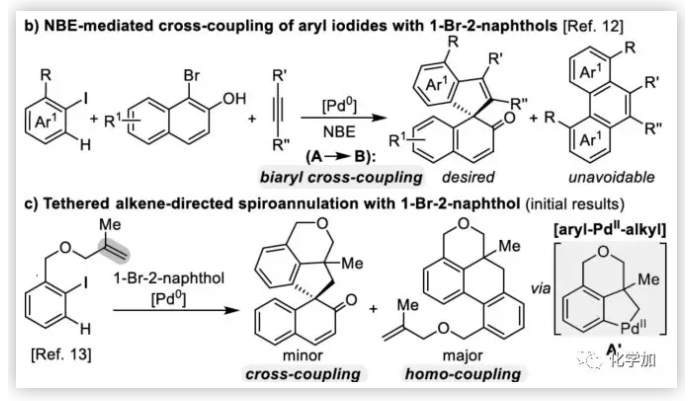
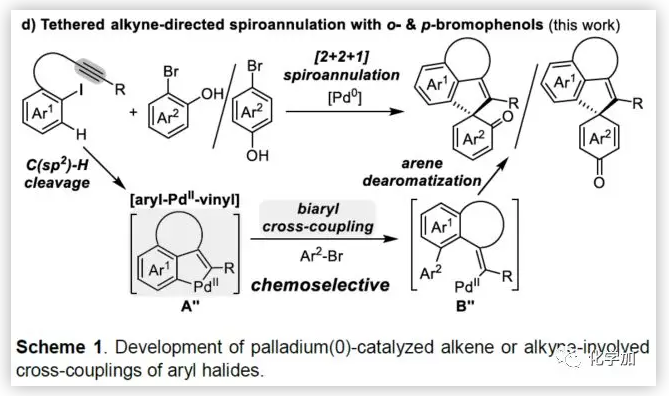
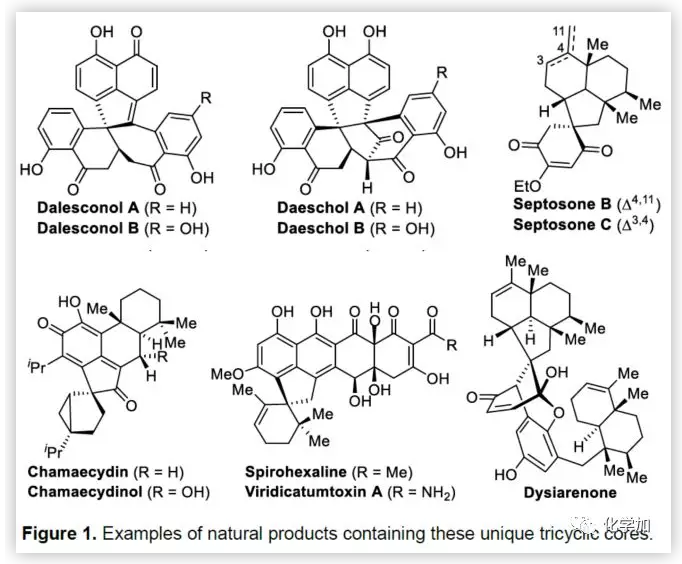
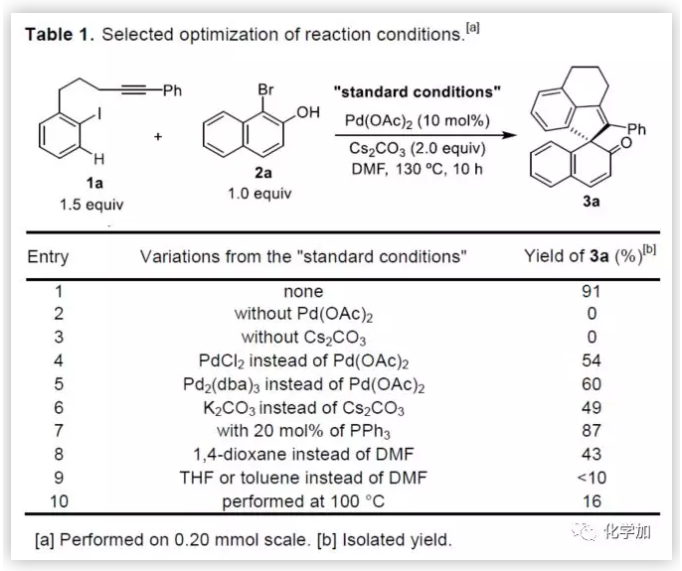
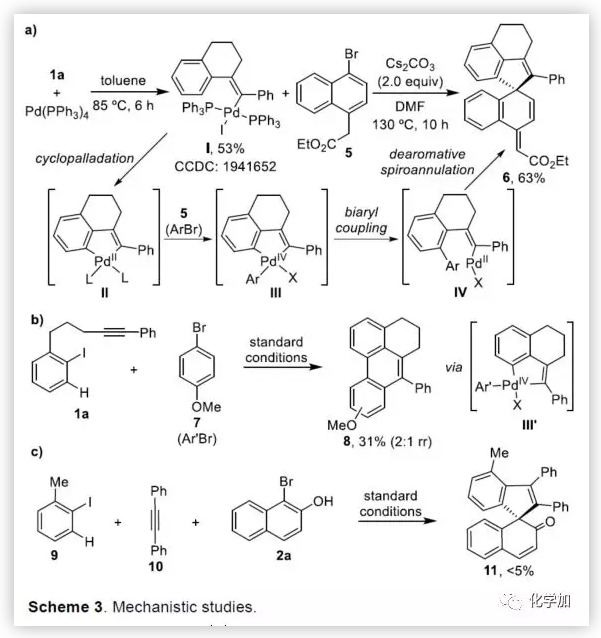
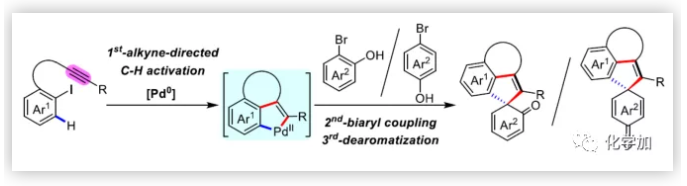
联芳基骨架广泛存在于生物活性的天然产物、药物、手性配体和功能材料中。双分子芳基卤化物偶联是合成联芳基化合物最有效和通用的方法。自1901年Ullmann和Bielecki发现芳基卤化合物还原二聚的方法以来,现已成为制备对称联芳基的有效途径之一。在过去的几十年中,C-H官能团化的发展极大地革新了由两个芳基卤化物生成联芳基的策略,同时建立了逆合成分析的新范例。而Catellani反应(降冰片烯与Pd共同催化)作为典型的代表,已成为直接构建无数非对称联芳基非常有效的方法。为了制备多种非对称的联芳基多环骨架,需要对两个底物进行修饰,方法为邻位带有给电子基的芳基碘化物和带有吸电子的芳基卤化物(Cl或Br)进行反应(Scheme a)。 (图片来源:Angew. Chem. Int. Ed.)基于作者对金属催化去芳化反应的长期研究,以及前期在Angew(2017, 56, 2767)发表的一篇论文(主要介绍钯和NBE共催化下实现1-溴-2-萘酚、芳基碘化物和炔烃[2+2+1]螺增环反应,而此反应的主要障碍是芳基碘化物的自身偶联)的基础上(Scheme b),作者提出了一种含烯烃的芳基碘化物与1-溴-2-萘酚经中间体A'实现螺增环反应(Scheme c)。与前期工作相比,螺环化反应从分子间变为分子内反应,从而避免自偶联的产生。但经过长期的尝试,作者发现,由于含烯烃的芳基碘化物也存在自身偶联问题,导致该反应很难顺利进行。 (图片来源:Angew. Chem. Int. Ed.)基于失败的经验,作者提出另一种设想,选择含炔烃的芳基碘化物与邻溴酚进行反应,通过芳基/乙烯基环钯中间体A''的参与抑制芳基碘化物二聚化(A、A'比A''更富电子),实现炔烃选择性的交叉偶联。在这里,作者成功开发了Pd(0)催化炔烃定向[2+2+1]螺增环反应,涉及C-H活化、联芳基形成和芳烃去芳化等(Scheme 1d)。(图片来源:Angew. Chem. Int. Ed.)此外,该类化合物被视为生物活性分子的核心骨架,如Dalesconols, Daeschols, Septosones等 (Figure 1)。因此,合成该骨架结构具有重要的意义。 (图片来源:Angew. Chem. Int. Ed.)作者,首先以1a和2a作为模型底物进行了条件筛选(Table 1)。令作者惊讶的是,这些底物在非常简单的条件下(entry 1)经化学选择性[2+2+1]螺环化反应,获得五环产物3a(收率91%)。为了阐明每种反应物的作用,作者继续进行了一些对照实验。催化量的钯和化学计量的碱在炔烃定向C-H活化和芳烃去芳化的多米诺过程中起着关键作用(entries 2-3)。其它的钯源(PdCl2和Pd2(dba)3)碱(K2CO3)也适用,但导致3a收率降低(entries 4-6),而膦配体的参与并没有影响反应结果(entrie 7)。此外,溶剂和温度也都对反应至关重要(entries 8-10)。与之前通过Pd(0)/NBE协同催化进行的反应相比,该反应具有反应简单(无需NBE和配体参与)、高合成效率(收率高达91%)以及避免了芳基碘化物二聚等优点。 (图片来源:Angew. Chem. Int. Ed.)
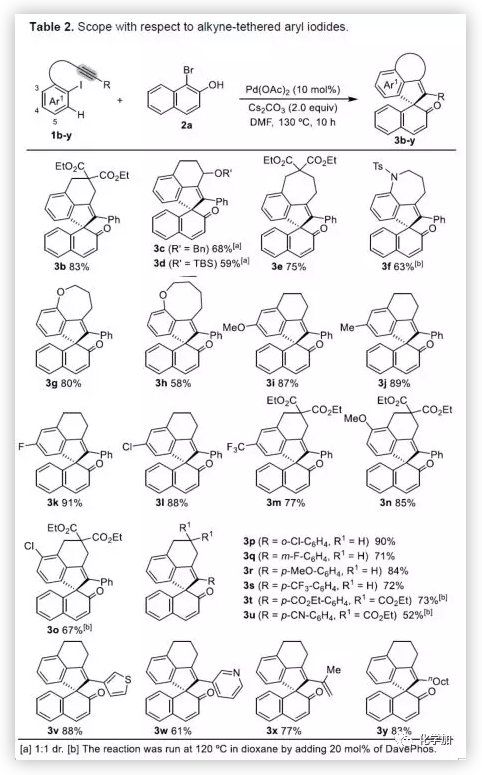
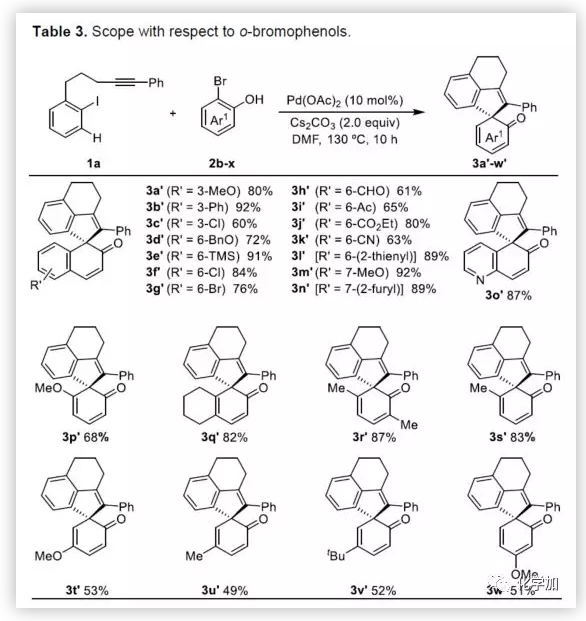
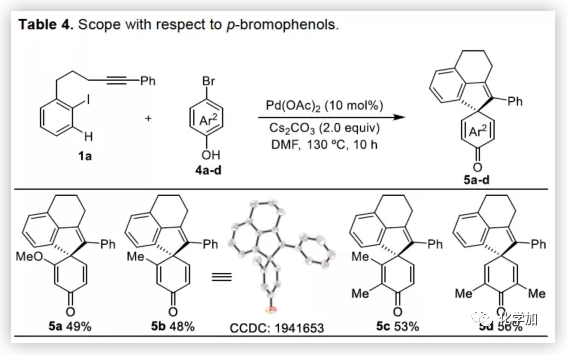
在获得上述最佳反应条件后,作者开始对底物进行了扩展(Table 2)。首先,以溴代萘酚2a与含炔烃的芳基碘化物进行底物扩展,获得产物3b-y,均取得良好的收率(52-91%)。此外,通过炔烃链的增长,该方法可以合成含杂原子(O、N)的七、八环螺环化物(3e-3h),同时电子效应和定位效应(芳基3,4-位)对反应影响不大(3i-3o),但是芳基5-位取代由于存在空间位阻的原因导致不能形成环钯中间体,以致不能实现C-H活化。而炔基取代的部分,同样不受电子效应的影响(3m-3u),杂环化合物(3v-3w)、烯烃(3x)和脂肪烃(3y),均能够保持相同的活性和选择性。(图片来源:Angew. Chem. Int. Ed.)随后,作者对底物溴代萘酚2a进行了扩展。首先,作者将1-溴-2-萘酚的3,6,7-位不同取代的化合物分别与1a进行反应,反应结果令人满意(收率60-92%),更为重要的是,一些敏感性基团能够在反应中不受影响,如三甲硅烷基、卤原子、甲(乙)酰基、酯、氰基等(3c'-3k')。此外,杂环底物也能顺利反应,以87%的收率得到3o'。一些简单的溴酚同样可以合成螺环产物(3r'-3w')。 (图片来源:Angew. Chem. Int. Ed.)为了验证邻溴酚的羟基是否在形成环钯中间体进行联芳基偶联中起关键作用,作者将对溴苯酚引入反应体系。令人满意的是,底物4a-d与1a均很好地参与了[2+2+1]螺环合成,获得产物5a-d(收率48-56%),化合物5b的结构得到单晶确证。这些结果表明,邻位螯合基团(通常在环钯中间体的促进下,实现联芳基交叉偶联)对于该反应并不是关键因素。 (图片来源:Angew. Chem. Int. Ed.)受上述结果的鼓励,作者进一步尝试使用溴萘5来进一步扩大底物的范围,反应结果显示,以89%的收率得到去芳化产物6(Scheme 2)。 (图片来源:Angew. Chem. Int. Ed.)为了进一步了解反应机理,作者进行了一些对照实验(Scheme 3)。首先,1a通过分子内碳钯化反应,形成配合物I,再与当量的芳基溴化物5反应获得螺环产物6,产率为63%(Scheme 3a)。同时根据文献的总结,通过环钯化反应形成关键中间体II,随后与溴代芳基物进行配位,形成四价Pd配合物III,进而进行分子间联芳基偶联,去芳化螺环化反应,形成产物6(Scheme 3a)。为了进一步验证反应机理的正确性,作者以1a与7进行反应(Scheme 3b),结果表明:(1)四价钯III'和III作为该类反应的中间体;(2)III'的还原消除和C-H芳基化分两步实现。此外,三组分反应表明(Scheme 3c),含烷基醚的碘代芳基对于这两种不同的芳基卤化物的分子间交叉偶联至关重要。 (图片来源:Angew. Chem. Int. Ed.)总结:西北大学栾新军教授课题组开发了一种Pd(0)催化下实现含炔烃的芳基卤化物与溴代酚[2+2+1]的螺环化反应,以优秀的化学选择性和产率形成了新颖的螺环骨架化合物。通过关键中间体芳基/乙烯基钯环的引入,避免了各类自偶联的产生,同时不受文献中邻位螯合基团的影响,具有底物简单易得、底物范围广泛等优点。
撰稿人:彬彬