

图片来源:Angew. Chem. Int. Ed.
催化不对称去芳构化反应是把简单的平面芳香性分子转变成结构复杂的手性环状骨架的一种重要方法。作者之前已经实现了Pd催化的[3+2]环化使硝基芳烃如硝基苯并呋喃、硝基苯并噻吩和硝基吲哚去芳构化。在过渡金属催化下,氨茴内酐既可以作为亲电胺化试剂(图1a),也可以通过环化形成其他芳环(图1b)。仅有两篇氨茴内酐在过渡金属催化下的[4+3]环化去芳构化反应,但是它们也仅限于外消旋反应模式(图1c)。因此,在Pd催化剂作用下,以氨茴内酐为亲电试剂的新的反应模式将是非常理想的(图1d)。然而,该模式面临两个主要挑战:(1)在Pd催化剂作用下,氨茴内酐中的N-O键很容易断裂,产生了化学选择性问题;(2)氨茴内酐活性较差,需要进行活化。作者最近发现三乙基硼烷是一种很好的氨茴内酐活化剂,在Pd-催化下可以实现氨茴内酐和VCPs的[4+3]环化去芳构化反应。
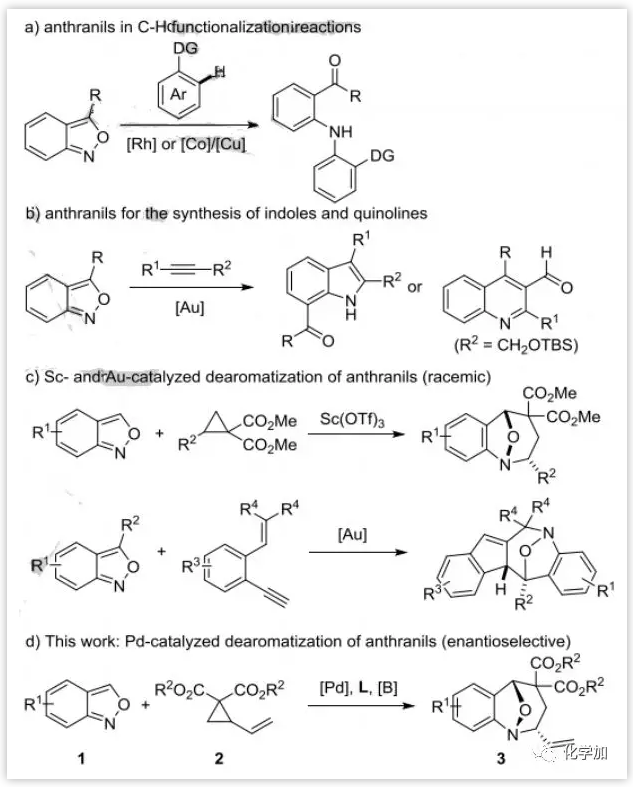
图1:氨茴内酐的去芳构化反应(来源:Angew. Chem. Int. Ed.)
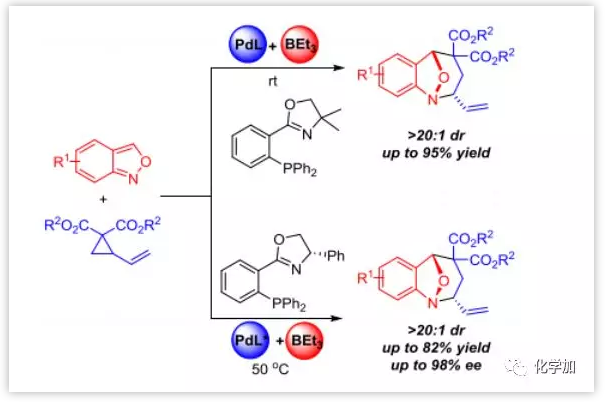
作者采用氨茴内酐1a和VCP衍生物2a作为标准底物。发现不加活化剂时反应不能进行,而在添加50 mol%的Et3B时能以71%的产率,>20:1 dr和65%的ee得到去芳构化产物3aa。对于配体的研究发现PHOX配体L5具有最佳的对映选择性(73% ee),而使用非手性PHOX配体L8,以最高73%的产率和>20:1 dr得到3aa。(图2)。
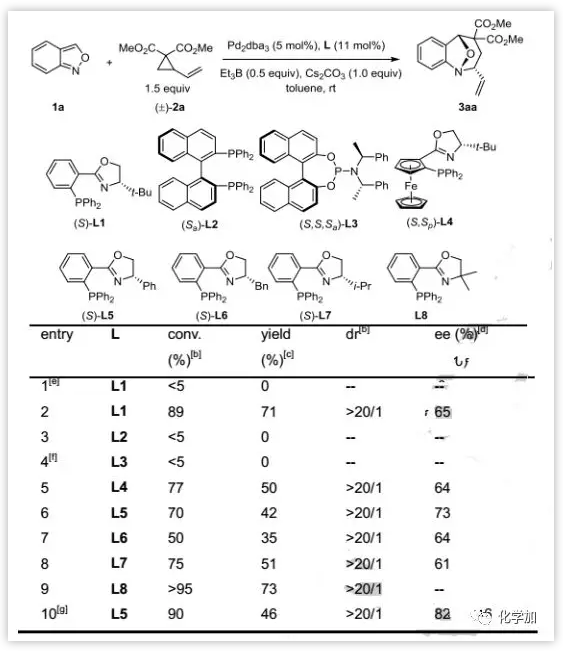
图2:条件优化(来源:Angew. Chem. Int. Ed.)
进一步优化发现,当反应温度升高到50 oC时,反应具有优异的对映选择性(98%ee)。而继续增加反应温度时,反应的产率和对映选择性都有所降低。最终发现在5 mol%的[Pd(ƞ3-C3H5)Cl]2,15 mol%的L5,50 mol%的Et3B,1.0当量的Cs2CO3,50 oC下t-BuOMe作为溶剂为最佳反应条件(图3)。
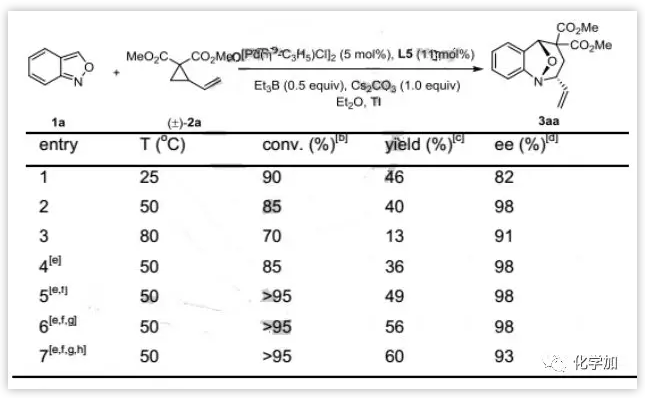
图3:条件优化(来源:Angew. Chem. Int. Ed.)
在确定最优反应条件后,作者首先选用非手性的PHOX配体L8研究了外消旋反应的底物范围。带有各种取代基,如卤素、酯、三氟甲基、氰基、甚至硝基的氨茴内酐与2a反应都能以良好到优秀的产率(51%~89%)得到单一非对映异构体的产物。此外,给电子的甲基在该反应中也是相容的,以61%的产率得到3ga。含有手性酯的底物也以67%的产率生成3na,反应的立体选择性不受手性取代基的影响。此外,空间位阻较大的异丙基、叔丁基和苄基的VCP底物2b-d也是相容的(图4)。
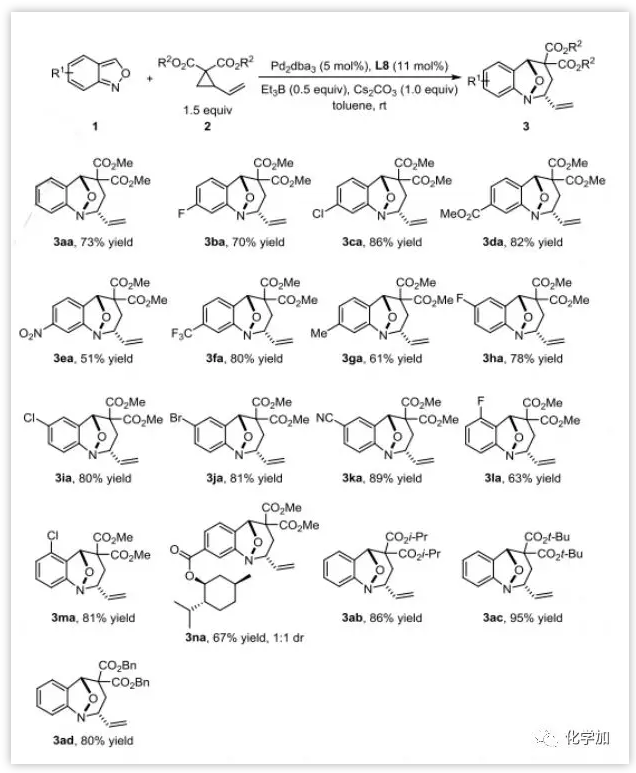
图4:底物拓展(来源:Angew. Chem. Int. Ed.)
接下来,作者又研究了不对称[4+3]环化去芳构化反应的底物范围(图5)。各种取代的氨茴内酐都能很好的反应,以优异的非对映选择性(16:1->20:1 dr)和良好至优异的对映选择性(86-98% ee)得到去芳构化产物。但是与外消旋反应相比,产率普遍偏低,这可能是相对较高的温度导致的。手性底物1n也能以极好的非对映选择性(16:1 dr)进行反应。化合物3ca还由X-射线单晶衍射确定了其结构和立体化学。
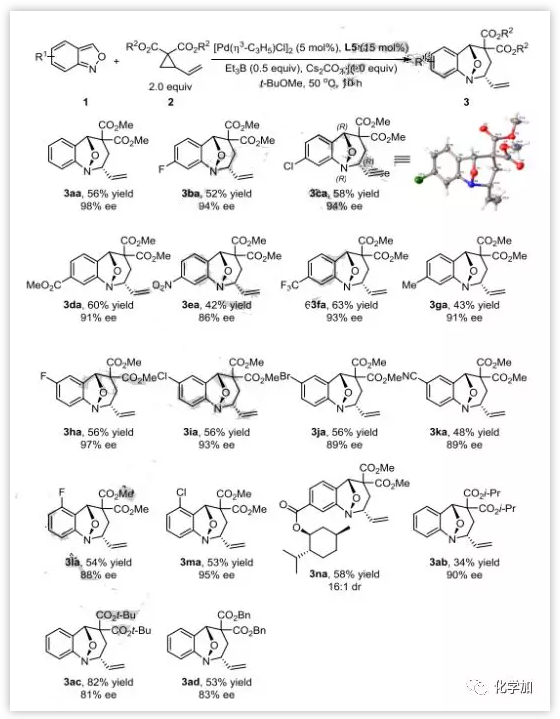
图5:不对称去芳构化反应底物拓展(来源:Angew. Chem. Int. Ed.)
为了进一步证明该方法的潜在合成应用,作者对产物3aa进行了一系列衍生化实验。在Pd/C加氢反应条件下,产物3aa中的N-O键和末端烯烃均发生转化。此外,在锌、醋酸、乙酸酐条件下N-O键断裂,氨基被原位保护。在锌、醋酸条件下直接还原3aa得到不稳定的四氢-1-苯并氮杂䓬,其与乙烯基溴化镁发生亲核加成,生成1:1 dr的6(图6)。
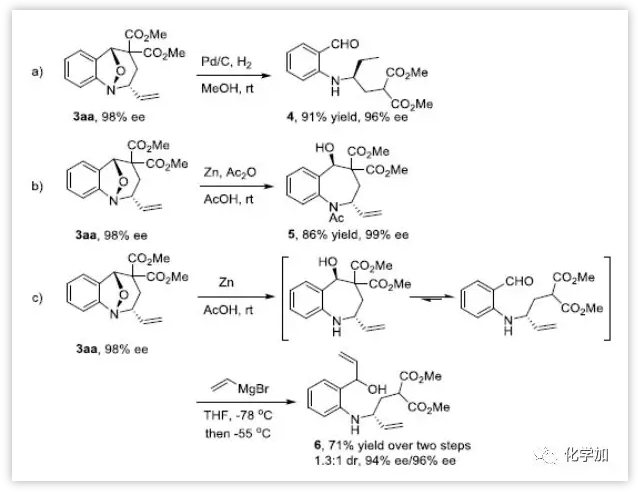
图6:衍生性实验(来源:Angew. Chem. Int. Ed.)
作者通过控制实验进行了机理探究。在不添加2a时,观察到1a的部分消耗。不添加Et3B时反应不能进行,表明三乙基硼烷起到活化氨茴内酐的作用,并且在此反应过程中,1a基本没有反应,2a则被完全消耗。表明,这两种底物在该反应条件下是不稳定的,这可能是导致中等收率的原因。此外,在没有Cs2CO3的情况下不发生反应,也没有底物的消耗。Cs2CO3既可用于反应的脱水,也可用于中和反应中潜在的酸。1H NMR结果表明,加入Et3B后,氨茴内酐的化学位移降低,说明Et3B与氨茴内酐有配位作用。此外,11B NMR实验还揭示了Et3B与氨茴内酐混合时新物质的生成(图7)。
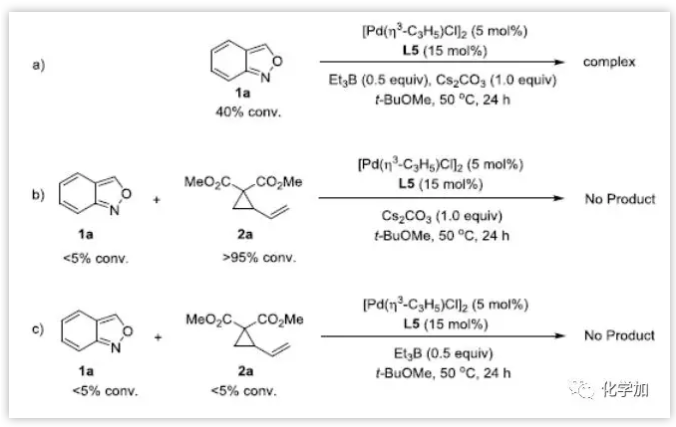
图7:控制实验(来源:Angew. Chem. Int. Ed.)
基于此,作者提出了一个合理的催化循环(图8)。首先,钯催化剂与VCP(2a)配位然后氧化加成生成中间体A,同时Et3B与氨茴内酐1a配位生成可能的中间体B。接下来,催化剂控制的A与B的去芳构化加成生成中间体C。随后发生分子内烯丙基环化得到目标产物3aa。最后,释放硼烷和钯催化剂以完成催化循环。
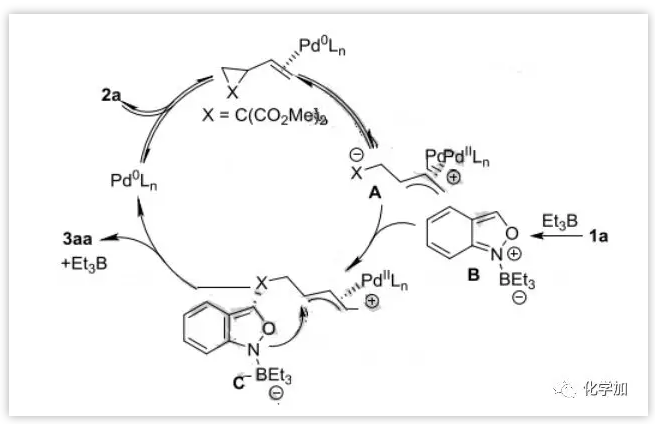
图8:反应机理(来源:Angew. Chem. Int. Ed.)
总结:上海有机化学研究所的游书力课题组开发了钯催化的氨茴内酐和乙烯基环丙烷的[4+3]环化去芳构化反应,以良好到优秀的产率和优异的立体选择性得到了桥联环状产物。硼烷作为一个关键的活化剂,可能形成了硼烷-氨茴内酐复合物。
撰稿人:残月
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn