

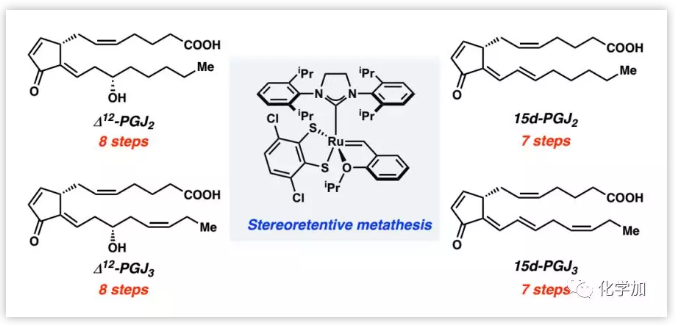
前列腺素是一类存在于哺乳动物组织中,具有广泛生物学功能的天然产物。Δ12-前列腺素J家族天然产物(1-4, Scheme 1)具有独特的交叉共轭二烯酮片段和显著的抗癌活性。其中,Δ12-PGJ3(3)可以选择性地诱导白血病干细胞凋亡,是治疗白血病的有效候选药物。自2003年开始,关于Δ12-PGJ2(1)和15d-PGJ2(2)的全合成不断被报道;Nicolaou课题组不仅报道了Δ12-PGJ3(3)的全合成,还合成了一系列Δ12-PGJ3类似物,针对其抗癌活性进行了构效关系研究。
在天然产物合成中,烯烃交叉复分解是构建C=C键的重要方法。传统的复分解催化剂立体选择性不佳,此前极少用于Δ12-PGJ家族天然产物的全合成中。因此,开发具有立体选择性和烯烃-化学选择性的复分解催化剂显得尤为关键。近日,加州理工学院Robert H. Grubbs和Brian M. Stoltz教授与南方科技大学徐晨等人通过利用简明的立体控制的烯烃复分解策略完成了富含烯烃的Δ12-前列腺素J类天然产物1-4的全合成,该成果发表在J. Am. Chem. Soc.上(DOI: 10.1021/jacs.8b12816)。
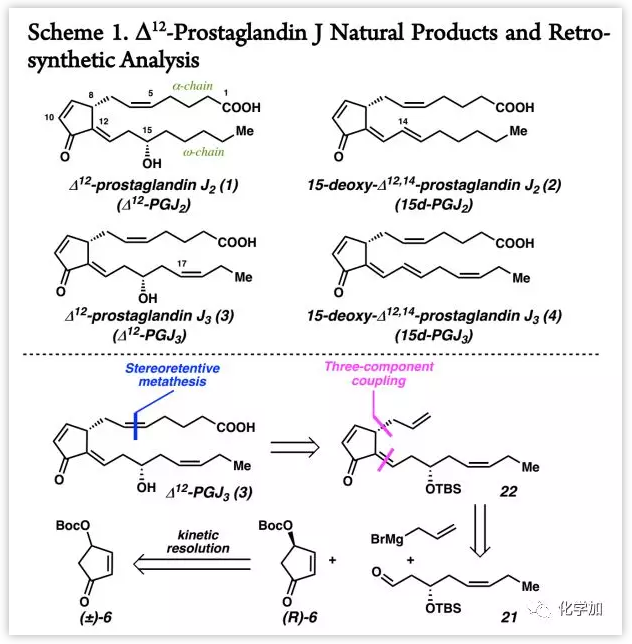
Δ12-PGJ3(3)的逆合成分析(Scheme 1):
作者通过立体控制的复分解反应将Δ12-PGJ3(3)简化为中间体22,其可以由市售的烯丙基格氏试剂、ω-链醛21和手性环戊烯酮(R)-6通过三组分偶联策略构建,而(R)-6中的O-Boc可以作为导向基团诱导产生C8手性中心。
(图片来源:J. Am. Chem. Soc.)
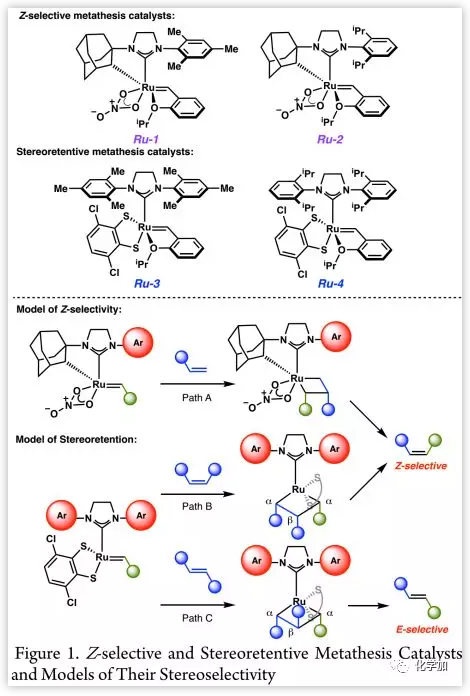
最近,Grubbs课题组开发了一系列环金属化钌催化剂(如Ru-1,Ru-2,Figure 1),并通过顺式金属环丁烷中间体实现了顺式选择性复分解反应(Figure 1, Path A);Hoveyda课题组开发了基于儿茶二硫酸盐的催化剂Ru-3及其二硫醇盐变体,在开环复分解聚合、开环交叉复分解和与顺式烯烃的交叉复分解中显示出了很高的顺式选择性;Materia Inc.和Grubbs课题组开发了Ru-3,sIPr类似物Ru-4等具有立体控制的催化剂,其能够进行立体控制的原因在于侧链金属环丁烷中间体的形成,其中α-取代基被迫向下以减小与NHC的大体积N-芳基的空间相互作用。因此,当用顺式烯烃为原料,β-取代基指向下以产生顺式烯烃产物(Figure 1, Path B);当反式烯烃为原料,β-取代基必须指向两个N-芳基之间位阻小的区域,产生反式烯烃(Figure 1, Path C)。然而,由于亚甲基中间体不稳定、易导致催化剂分解,使得立体控制复分解催化剂不可能在两个末端烯烃之间进行交叉复分解。最近,有文献报道了采用亚甲基封闭策略作为该问题的补救措施,使得两种端烯能够进行交叉复分解。
(图片来源:J. Am. Chem. Soc.)
对于Δ12-PGJ2(1)的合成:作者以糠醇为原料,通过包括Reiser课题组开发的动力学拆分方法(Scheme 2A)等三步反应制备手性环戊烯酮(R)-6;ω-链醛10由己醛(7)通过不对称Keck烯丙基化、TBS保护和臭氧分解(Scheme 2B)等步骤合成。然后,ω-链醛10和(R)-6与烯丙基格氏试剂通过非对映选择性共轭加成,脱除Boc保护基后形成所需的环戊烯酮,最后用MsCl/DMAP进行消除生成12E-产物11(两步45%,Scheme 2D)。
接下来,作者利用Ru-4(1 mol%)作为催化剂和11作为底物评价了立体控制的复分解反应,通过动态真空从反应混合物中除去副产物顺式-3-己烯,可以实现98%的转化率。接下来,将另一含催化剂Ru-4(5 mol%)的11加入到反应混合物中,可以提高顺式选择性(Z>99%),并以95%的产率分离得到醇14。因此,确立了利用“一锅法”立体控制性同源二聚化/交叉复分解策略构建C5Z-烯烃。最后,14经Ley氧化和脱保护得到Δ12-PGJ2(1)。
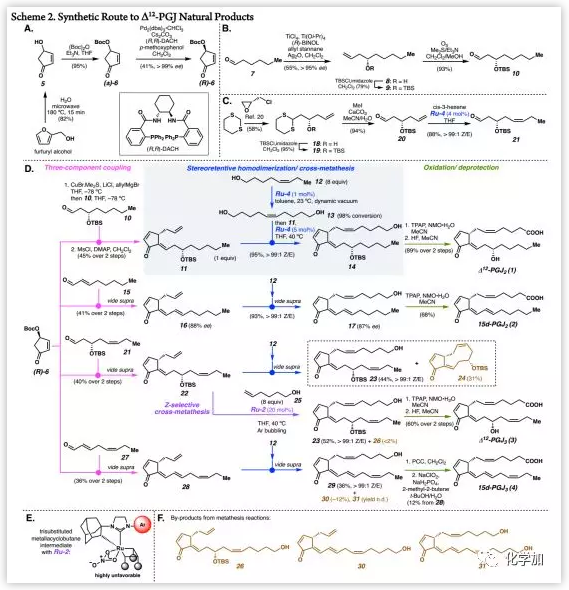
(图片来源:J. Am. Chem. Soc.)
随后,作者利用相同的三组分偶联合成得到16,其中醛15的烯醛官能团在醛醇反应中具有良好的耐受性。然后,将16进行“一锅法”立体控制的同二聚化/交叉复分解反应以极好的收率(93%,Scheme 2D)和顺式选择性(Z>99%)得到醇17。此外,利用催化剂Ru-4进行的立体控制的复分解反应保留了C8位的立体化学。最后,17经Ley氧化得到15-脱氧-Δ12,14-PGJ2(2)。
Δ12-PGJ3(3)的合成:首先,作者利用(R)-epichlorohydrin按文献方法制备手性醇18(Scheme 2C),再经TBS保护和脱除1,3-二硫醇以及立体控制的烯烃复分解得到ω-链醛21(Z>99%),然后与(R)-6经三组分偶联得到22(Scheme 2D)。随后,作者用环金属化催化剂Ru-2规避可能出现的交叉烯烃复分解反应;由于三取代的金属环丁烷中间体对该环金属化催化剂非常不利,因此很容易避免该途径(Scheme 2E)。利用22中烯丙基与5-己烯-1-醇(25)进行化学选择性交叉复分解反应以良好的收率(52%)得到产物23及痕量副产物26(少于2%,Scheme 2F),未观察到RCM产物24。然后,23经Ley氧化、脱TBS保护基得到Δ12-PGJ3(3)。
最后,在15d-PGJ3(4)的合成中,可以预期烯丙基和28中C17-Z-烯烃之间的复分解反应。在标准的立体控制复分解反应条件(Ru-4)下,反应以36%收率得到预期产物29以及副产物30和31(Scheme 2F)。Δ12-PGJ3(3)中OTBS的空间位阻有利于获得良好的化学选择性,而28不含这种空间位阻。然而,可能是由于RCM产物的环应变效应,未观察到28发生闭环复分解。虽然29和30难以分离,但经后续PCC氧化和Pinnick氧化后,可以分离得到15-脱氧-Δ12,14-PGJ3(4)。
小结:Robert H. Grubbs教授和Brian M. Stoltz教授与南方科技大学徐晨等人报道了通过立体控制和立体选择性烯烃复分解反应利用较短的步骤(7~8步)完成了Δ12-PGJ家族四种天然产物的全合成,为该类化合物的构效关系研究奠定了基础。此外,作者还评价了立体控制复分解的反应性、化学选择性和官能团相容性,对烯烃复分解反应在全合成中的广泛应用起到了关键作用。
撰稿人:爽爽的朝阳
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn