

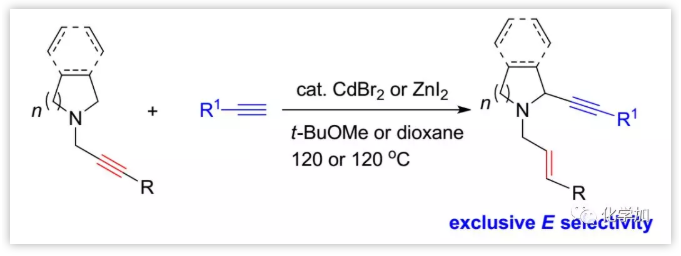
环胺在合成化学以及生物学上均具有重要作用,因此,对其合成方法的开发引起了越来越多的关注。目前,一种方法是通过环胺的α-官能化合成;另一种方法是通过N-保护的环胺与端炔或1-炔基三氟硼酸盐的氧化偶联(eq. 1,Scheme 1)或未保护的环胺与端炔和醛的三组分反应构建(eq. 2)。此前,中国科学院上海有机所麻生明院士课题组曾报道了ZnX2、CuI或CuBr2介导的端炔与醛在不同胺存在下进行末端二烯的烯基化以合成丙二烯的方法。Nakamura等人报道在该反应中炔丙胺进行金属-介导的1,5-H迁移反应是非立体选择性的。近日,麻生明院士课题组在Chem. Sci.报道了一种高度立体选择性的N-炔丙基环胺的α-炔基化方法(eq. 3),通过用CdBr2(或ZnI2)催化剂可以得到N-(E)-烯丙基2-炔基环胺。
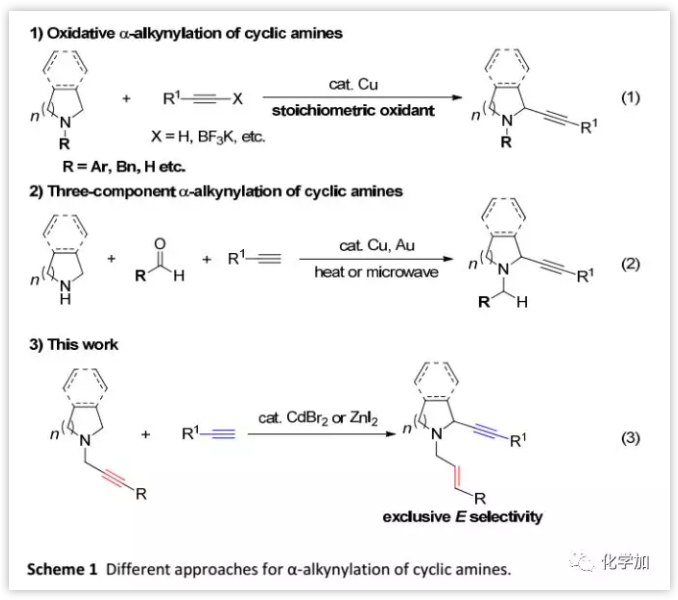
(图片来源:Chem. Sci.)
反应条件的优化:
作者在胺存在下研究Cu-催化的端炔的丙烯酰化机理时,发现N-炔基胺1a与苯乙炔2a在CuBr催化下反应得到新产物3aa(13%),通过1H NMR分析确定该产物N-烯丙基中的C=C键为E式。通过筛选各种金属盐进一步优化了反应条件,并且发现CdBr2效果最好,可以42%的产率得到3aa,并且1a回收率为52%;当提高反应温度(120 ℃)后,产率提高至56%,回收率为20%。

(图片来源:Chem. Sci.)
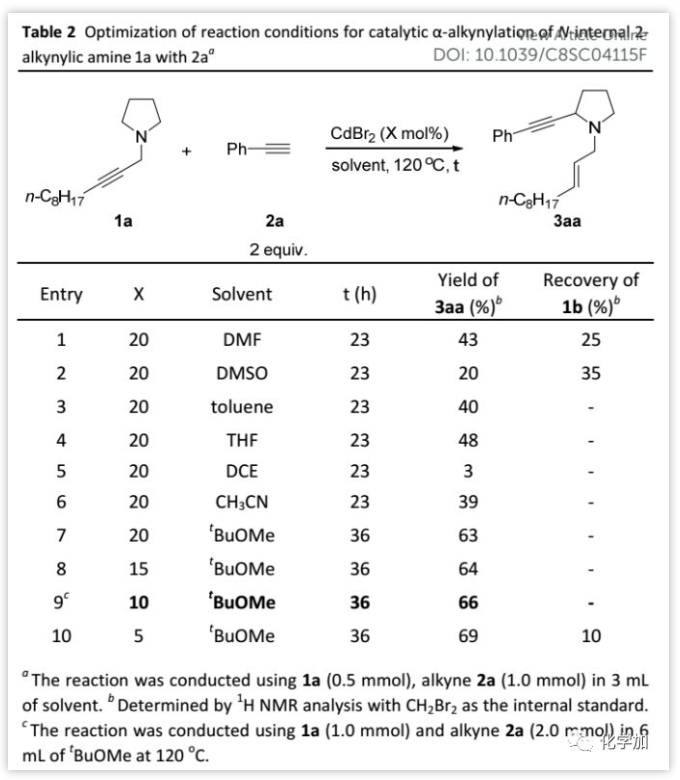
溶剂的作用(Table 2):
接下来,作者筛选了反应溶剂:发现以t-BuOMe作溶剂时,底物1a完全消耗并以63%的产率得到预期产物3aa。此外,将催化剂负载量降至10 mol%时,产率略微提高(66%);进一步降低催化剂负载量会导致1a反应不完全。因此,作者确定了优化的反应条件:反应温度为120 ℃,溶剂为t-BuOMe,反应配比为1a(1 eq)/2a(2 eq)/CdBr2(10 mol%)。
(图片来源:Chem. Sci.)
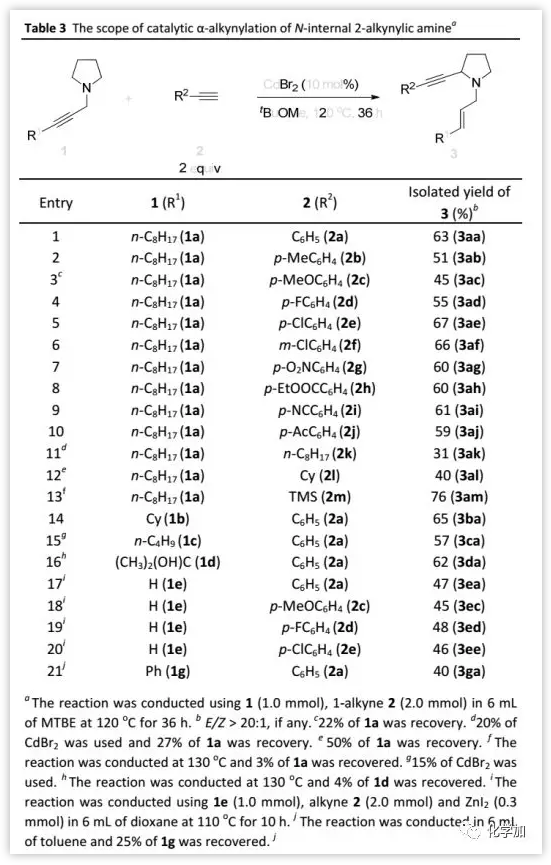
底物的适用范围(Table 3):
在最佳反应条件下,作者以胺1a为底物筛选了进行α-炔化的末端炔烃的适用范围。当端炔芳基含有给电子基团如p-Me、p-MeO,吸电子基团如p-F、p-Cl、m-Cl、p-NO2、p-EtOOC、p-CN以及p-Ac时,均可以中等收率得到相应的产物3;当端炔含有烷基取代基时,如1-癸炔和环己基乙炔反应缓慢,产率较低(31%和40%)。此外,TMS乙炔可与1a反应以76%的产率得到3am,其它取代的炔丙胺如1b、1c、1d和1g也可以进行反应并以中等收率(40-65%)得到相应的产物。接下来,作者用含不同官能团如给电子基团p-MeO和吸电子基团p-F、p-Cl取代的芳基乙炔与炔丙胺1e反应,以中等产率得到相应的产物3ea-3ee。
(图片来源:Chem. Sci.)
首先,作者将优化的反应条件用于N-炔丙基四氢异喹啉衍生物1f和苯乙炔2a的反应(Scheme 2),结果仅以57%的分离产率得到1-烷基化产物。然而,当以ZnI2(10 mol%)为催化剂、1,4-二氧六环为溶剂时,反应以78%的产率得到3fa。另外,TMS乙炔和1-己炔也反应相当。
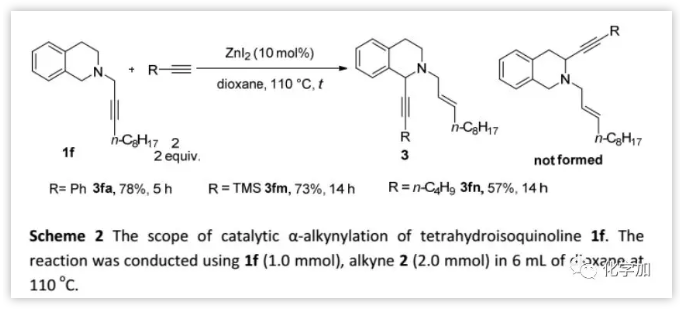
(图片来源:Chem. Sci.)
对于哌啶衍生物1h,反应需要更大的催化剂负载量并且需要甲苯作溶剂,但收率较低。此外,吗啉衍生物并不发生反应。
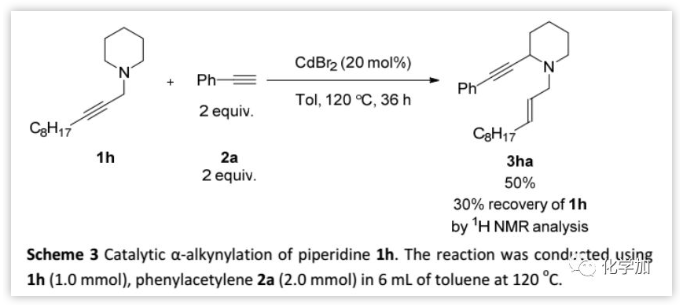
(图片来源:Chem. Sci.)
此外,作者还研究了几种非环胺(Scheme 4)。二异丙胺与苯乙炔反应,可以55%的产率得到1,2-十一碳二烯。然而,在标准反应条件下,二异丁胺和二烯丙基胺均未与苯乙炔2a发生反应。
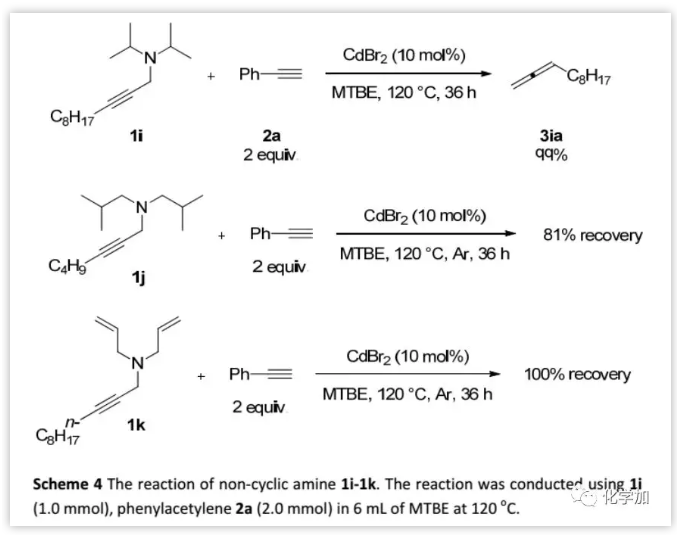
(图片来源:Chem. Sci.)
氘代实验(Scheme 5):
为了深入研究反应的机理,在标准条件下,作者用2a处理氘标记的d4-1a得到d4-3aa(95%D),这表明烯丙基的γ-H来自胺的α-位(Scheme 5a)。此外,氘标记的d-2a和1a反应得到产物d2-3aa中,氘代发生在N-烯丙基的2-位(24%D)(Scheme 5b)。在d-2a与3aa反应的对照实验中,产物不含氘元素(Scheme 5c)。
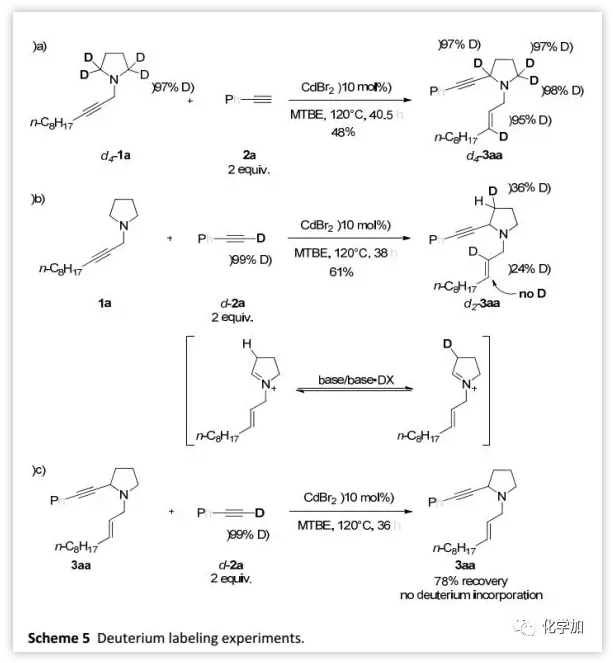
(图片来源:Chem. Sci.)
基于上述氘代实验和产物为E构型,作者提出了合理的反应机理(Scheme 6)。炔丙胺1与MX2配位形成Int 1,其经反式-1,5-H迁移形成双键处于E式的阳离子Int 2。随后,由端炔、CdBr2和胺原位生成的Int 3与亚胺离子Int 2反应得到α-取代的环胺3。此外,由于在eq. b(Scheme 5)的产物中E-烯丙基的3-位未发生氘代,排除了由烯丙胺1'生成产物的可能性,并且CdBr2更易于与C≡C配位从而触发1,5-H迁移反应。
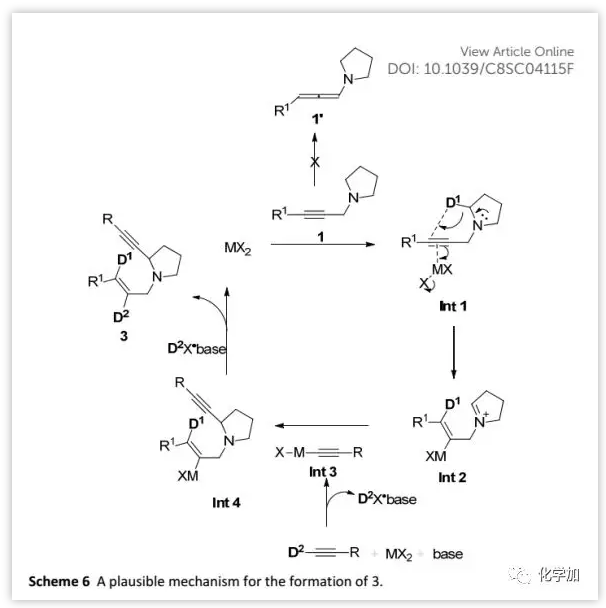
(图片来源:Chem. Sci.)
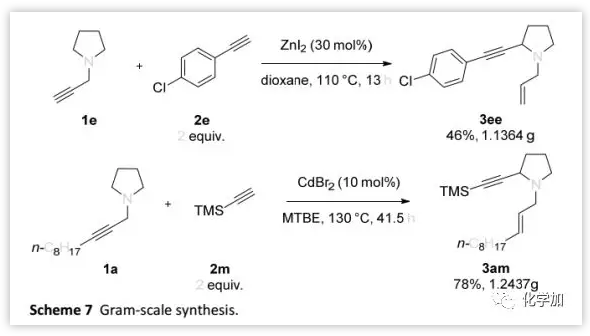
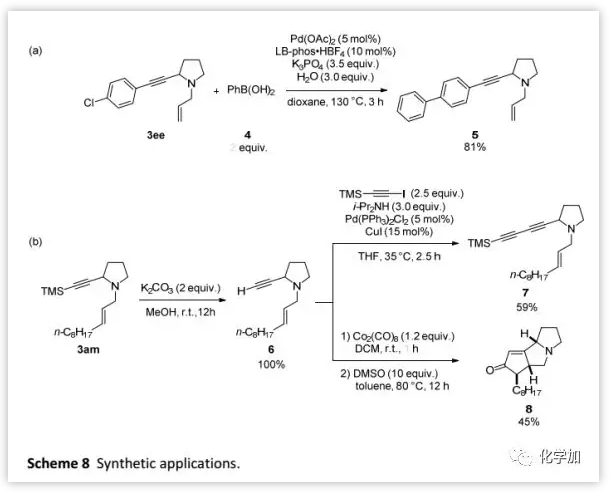
合成应用:
作者利用该反应完成了克级规模3ee和3am的制备 (Scheme 7)。此外,作者还证明了这两种化合物的多样化合成功能(Scheme 8)。其中,3ee和苯基硼酸进行Suzuki偶联可以得到5(Scheme 8a);而3am脱除TMS保护基后得到的烯炔6可以与1-三甲基甲硅烷基乙炔基碘反应得到共轭二炔7(Scheme 8b),并且6在Co2(CO)8和DMSO 条件下还可以进行Pauson-Khand反应得到产物8。
(图片来源:Chem. Sci.)
(图片来源:Chem. Sci.)
小结:麻生明院士课题组开发了一种金属催化的N-炔丙基环胺的α-炔基化方法,可以高度立体选择性地得到1-(2(E-烯基)-2-(1-炔基)环胺,该方法在天然产物合成中具有重要的应用。
撰稿:爽爽的朝阳
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn