

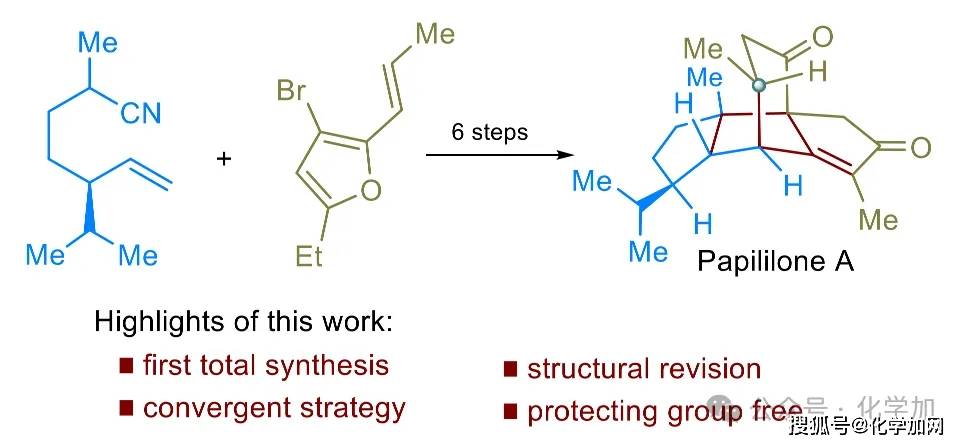
正文
具有稠合桥环骨架和多立体中心的多环萜类分子(如calidoustene、pleuromutilin和papililone A)(图1a)因其复杂笼状结构和显著生物活性成为合成领域的研究热点。与pleuromutilin二萜所具有的5/6/8三环骨架不同,papililone A(1)拥有独特的5/6/5/5稠合桥环四环骨架和相邻的季碳立体中心,显著提升了分子复杂性。这些分子的精巧结构不断激发合成化学家探索新型反应,如自由基环化、环化/重排串联反应等,以实现复杂天然产物及其类似物的高效、简洁合成。尽管近年来已取得一定进展,但开发普适性强、效率高的方法,以快速构建拥挤的笼状多环体系,仍是当前合成化学领域亟待解决的关键挑战。
Papililone A(1)是由贵州大学周康课题组于2022年从真菌Papiliomyces sp.中分离获得的一种新型二萜类天然产物,具有新颖的四环骨架和良好的抗炎活性(图1a)。从合成角度来看,其空间拥挤的笼状多环骨架带来了多重挑战:(a)稠合的线性三奎烷结构(A-C环)与高张力的六元桥环(D环)紧密连接,形成高度刚性的笼状骨架;(b)分子中包含六个连续的立体中心,其中包括两个相邻且高度拥挤的桥头全碳季碳中心,以及一个大位阻的β-异丙基取代基,增加了化学合成的难度。此外,近期的计算研究指出,该天然产物的C17-甲基构型应从先前推测的α构型修正为β构型,这也进一步提升了其合成的复杂性。截至目前,papililone A的全合成尚未见报道。
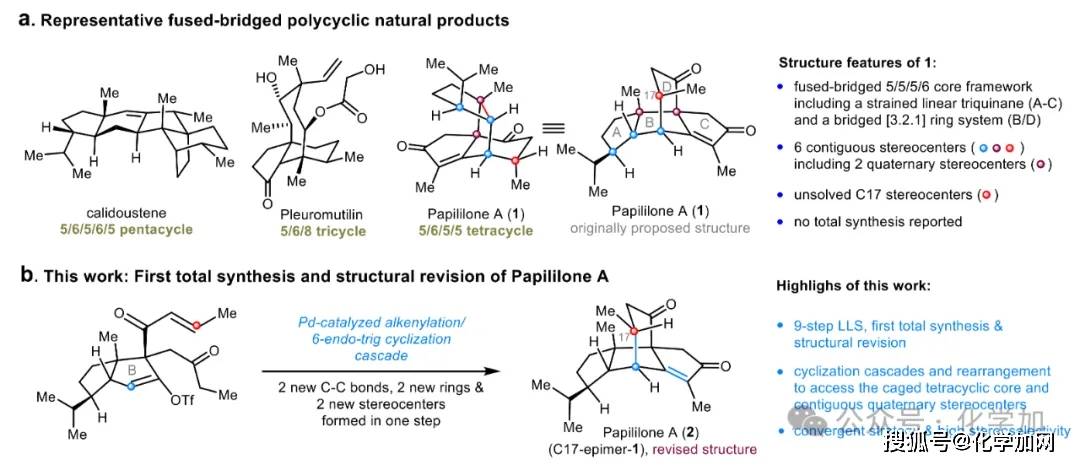
图1. 代表性稠合并桥多环萜类分子及Papililone A的首次全合成
近日,侯四化课题组利用极性-自由基串联环化、立体选择性1,2-加成、插烯α-醇酮重排、钯催化烯基化/共轭加成串联环化等关键反应,以9步线性最长步骤和无保护基的合成策略实现了(-)-papililone A的首次全合成,并修正了其C17位的立体构型。
在逆合成分析中(图2),作者提出天然产物papililone A(1)及其C17差向异构体(2)可通过双烯醇负离子过渡态TS-1经钯催化的酮烯基化/6-endo-trig串联环化反应,由化合物3高效构建。该串联反应可以一步形成两个新的C–C键、两个新的立体中心(C6和C17),并构建目标分子中关键的CD环系。中间体3的合成则依赖于关键的插烯α-醇酮重排反应与三氟甲磺酰化反应,起始原料为α,β-不饱和酮化合物4。该结构重组策略巧妙利用前体4中C19=O与C7–OH之间的分子内氢键(C19=O···HO–C7),有效调控反应构象,从而精准控制C1→C11的迁移过程,实现C11位全碳季碳立体中心的立体选择性构建。化合物4可通过汇聚式偶联策略制备:以呋喃片段5与环丁酮6进行1,2-加成,随后经氧化反应得到。而化合物6则可由腈基前体7经优势反应构象7a的非对映选择性极性-自由基环化反应高效构建。
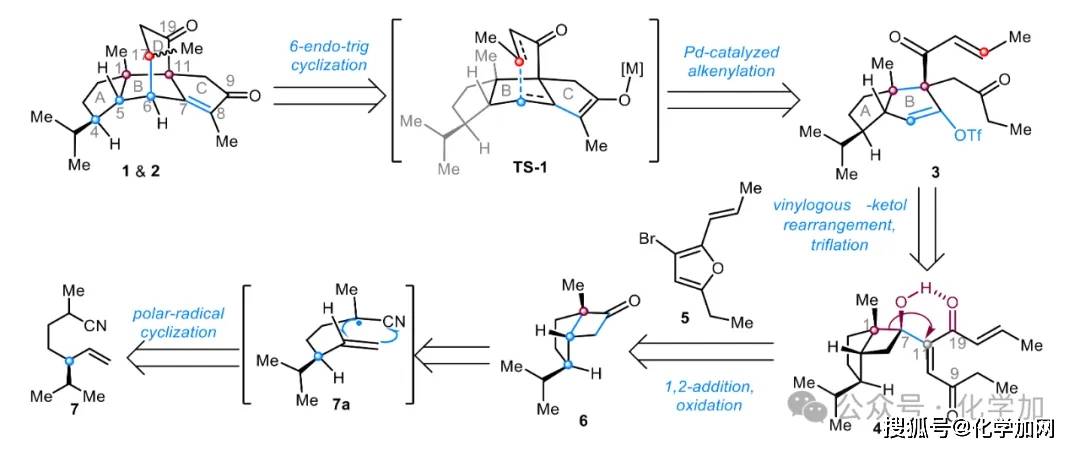
图2. Papililone A的逆合成分析
如图3所示,片段5和6的合成路线如下:已知炔丙醇8(一步制备)在i-PrMgCl存在下与Weinreb酰胺发生炔基化反应,以79%的收率得到炔酮9。化合物9在Obrecht条件下(HBr/HOAc)发生溴化环化反应,以54%的收率、克级规模制备3-溴呋喃5。烷基溴10(一步制备)与甲基丙烯酸酯在Mg、CuCl和TMSCl条件下发生Michael加成,经水解后以53%的收率得到羧酸11。最初,作者尝试通过酰胺12(由11与吡咯烷缩合制得)的 [2+2] 环化反应构建环丁酮6。尽管该反应收率较高,但非对映选择性较差(d.r. = 1:1.5),且主要生成不需要的非对映异构体6'。为提高立体选择性,作者转而采用Fleming极性-自由基环化策略,以期实现[2+2]环化的立体控制。经优化反应条件,ω-烯基腈7(由11与NH4HCO3反应制得)成功以60%的收率转化为单一非对映异构体6,非对映选择性高达d.r. > 20:1。该优异的立体选择性可能是由于β-异丙基取代基的空间位阻控制。化合物6的结构及相对构型通过其衍生物6a的X射线单晶衍射分析得以确证。
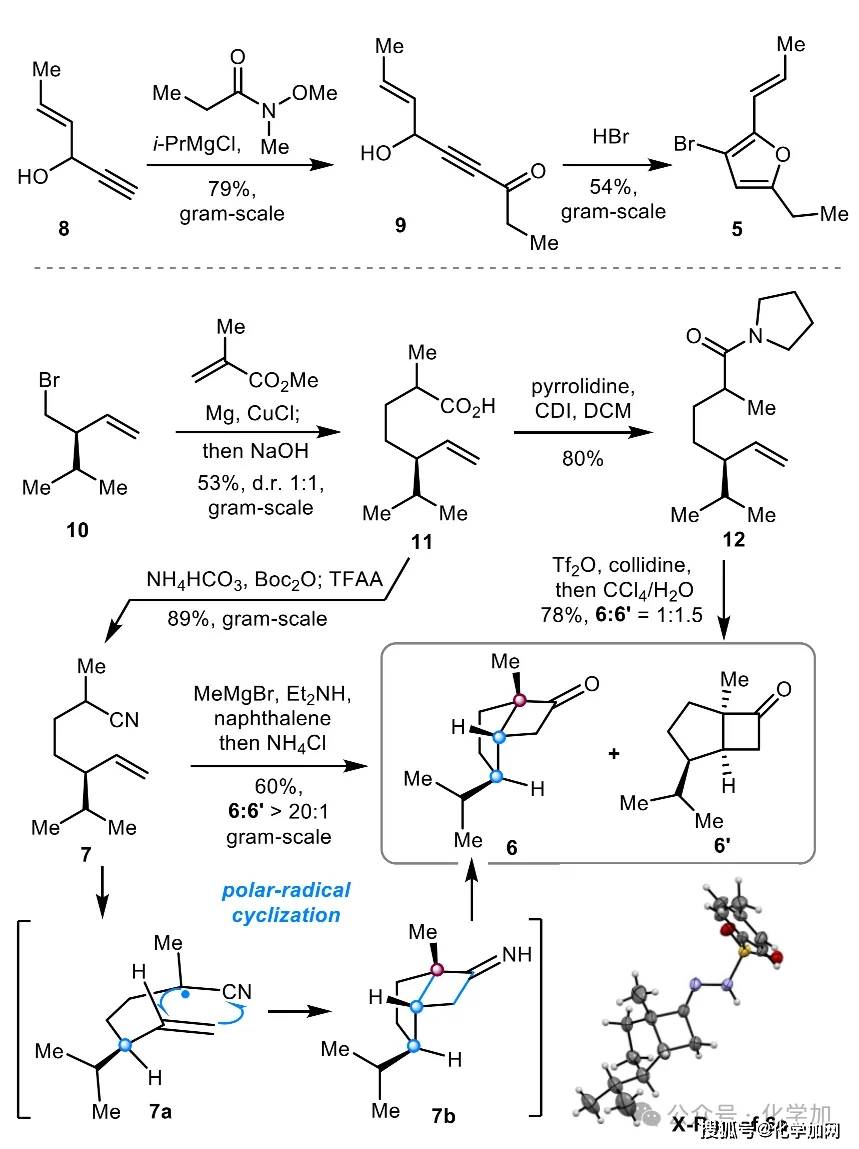
图3. 片段5和6的制备
如图4所示,3-溴呋喃5经n-BuLi处理发生锂-卤交换后,与5/4并环环丁酮6反应,以79%的收率得到非对映异构体混合物13/13'(d.r. = 1.1:1)。值得注意的是,引入镧盐LaCl₃·2LiCl作为添加剂后,反应的非对映选择性显著提升,以77%的收率获得单一非对映体13(d.r. > 20:1)。该反应的高立体选择性可能归因于LaCl₃·2LiCl与酮羰基在空间位阻较小的凸面螯合,从而迫使亲核试剂从更易接近的凹面进攻,从而实现立体控制。随后,在氧气、亚甲蓝和光照条件下,13/13'中的呋喃结构单元发生化学选择性氧化裂解,分别以87%和56%的收率转化为重排前体4和4',为后续的重排反应提供关键中间体。
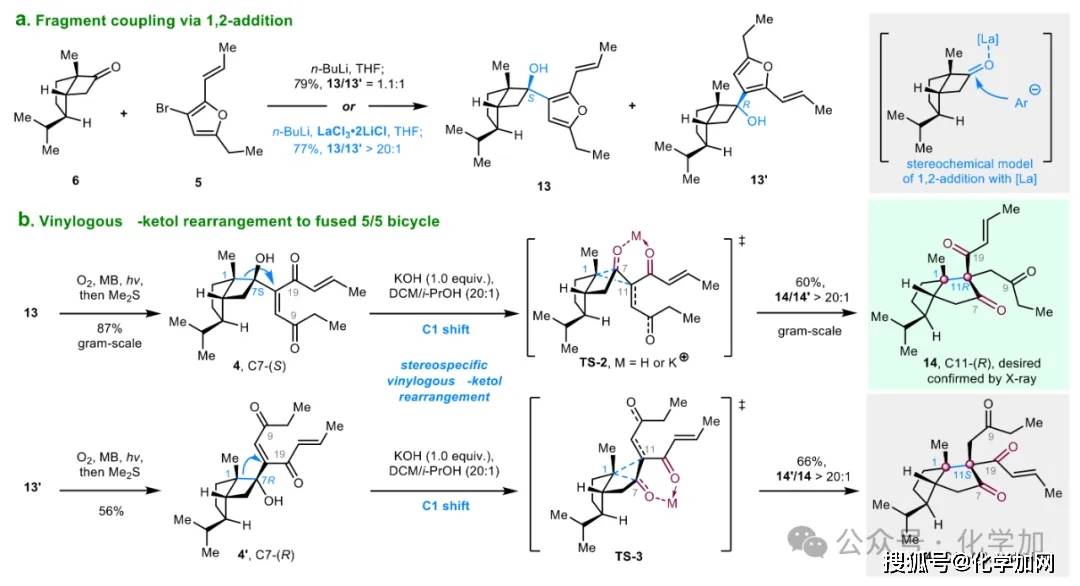
图4. 汇聚式策略合成5/5并环化合物
作者随后对关键的插烯α-醇酮重排反应进行了系统研究。尽管该重排反应已应用于α,β-不饱和环酮体系,但其在含不稳定共轭二烯酮的线性α,β-不饱和酮体系(如4)中的研究较少。初步尝试在路易斯酸(EtAlCl₂、BF₃·Et₂O、TMSOTf)条件下,底物4虽能完全消耗,但未能生成目标产物14。随后,作者发现KOH/i-PrOH/DCM体系可有效促进该重排反应,以60%收率得到预期目标产物14(d.r. > 20:1),其结构及新形成的C11位季碳的构型(11R)通过X射线单晶衍射得以确证。DFT计算表明,该重排过程的高立体选择性源于分子内氢键(C19=O···HO–C7)与空间位阻的协同调控,使反应通过能量更低的过渡态TS-2进行,从而控制重排反应的面选择性。相应地,前体4'(C7差向异构体)在相同条件下以66%收率(d.r. > 20:1)转化为产物14'(C11差向异构体),其C11季碳构型翻转为11S,进一步验证了该重排反应的立体化学机制的可靠性。
最后,作者尝试传统羰基缩合的合成策略,以aldol或Michael反应为关键步骤,构筑papililone A的高张力5/5/6三环结构(B-D环)(图5)。然而,在不同酸性(PTSA、(PhO)₂PO₂H)和碱性条件(HTMP、NaH、KHMDS)下,预期的aldol或Michael反应均未发生,无法构建目标分子的多环骨架。令人高兴的是,在LiHMDS与Comins试剂的反应条件下,三羰基化合物14以64%的收率转化为烯基三氟甲磺酸酯3,成为该合成路线的关键突破口。基于此,作者转而采用过渡金属催化策略,即通过钯催化的酮烯基化/6-endo-trig环化反应构建CD环,突破现有的合成瓶颈。尽管烯醇负离子的6-endo-trig环化(如中间体Int-1)因不利的立体电子效应而极具挑战,但系统优化发现钯催化剂对反应路径具有决定性影响:当使用PdCl₂或Pd(TFA)₂与配体DIOP时,反应主要发生烯基化/质子化过程,生成aldol型产物15(表1,条目1–2);而采用Pd(MeCN)₂Cl₂时,可有效促进烯基化/6-endo-trig环化串联反应,以13%收率得到笼状四环产物2(d.r. > 20:1)(条目3)。该产物的结构与立体化学经X射线单晶衍射得以确证。进一步降低配体用量可提升产物2的收率(条目4–5)。最终,在优化条件 [Pd(MeCN)2Cl2 (10 mol%)、DPPP (8 mol%)、甲苯、140°C] 下,以45%的收率获得2(d.r. > 20:1)。DFT计算表明,6-endo-trig环化的高非对映选择性源于椅式过渡态TS-1比船式过渡态TS-4低3.9 kcal/mol。
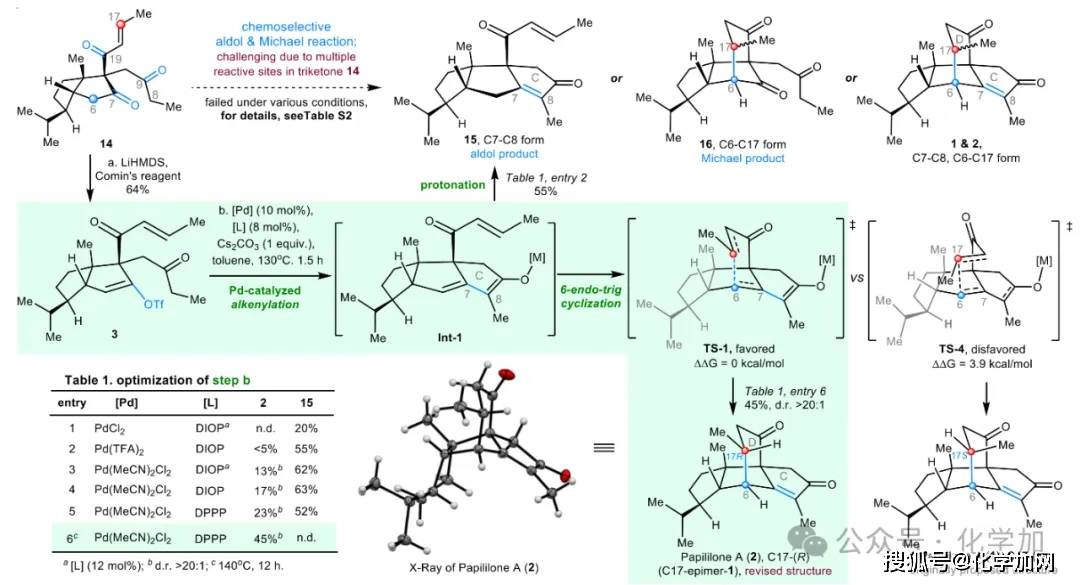
图5. 天然产物papililone A的全合成
化合物2的核磁共振谱图数据与天然papililone A完全一致,证实天然产物papililone A的真实结构为C17-(R)构型的2,而非最初所指定的C17-(S)构型。基于上述合成路线,由 (+)-10制备的(–)-papililone A(2)的圆二色谱(ECD)和旋光度均与天然样品一致,从而确证了天然(–)-papililone A的绝对构型。
总结
侯四化团队的这项工作不仅实现了papililone A的首例全合成,更展示了一种简洁、高效的合成策略。该策略的核心在于巧妙融合多种精心设计的新型反应:通过钯催化的烯基化/6-endo-trig环化串联反应构建5/5/6三环骨架;借助螯合导向的插烯α-醇酮重排精准控制C11立体中心;并利用极性-自由基串联环化构建环丁酮结构,有效调控环间连接的立体化学。此外,作者还巧妙地以呋喃前体为关键中间体,有效控制了共轭双烯酮中双键的几何构型,为后续立体选择性重排反应奠定了基础。这一系列反应的协同应用,充分体现了合成设计的逻辑性与创新性。该合成不仅成功解决了papililone A的结构争议,确立了其正确的构型,还为复杂多环萜类化合物的合成提供了新颖的策略与方法。这一成果也为后续相关生物活性研究和药物开发奠定了坚实的基础。
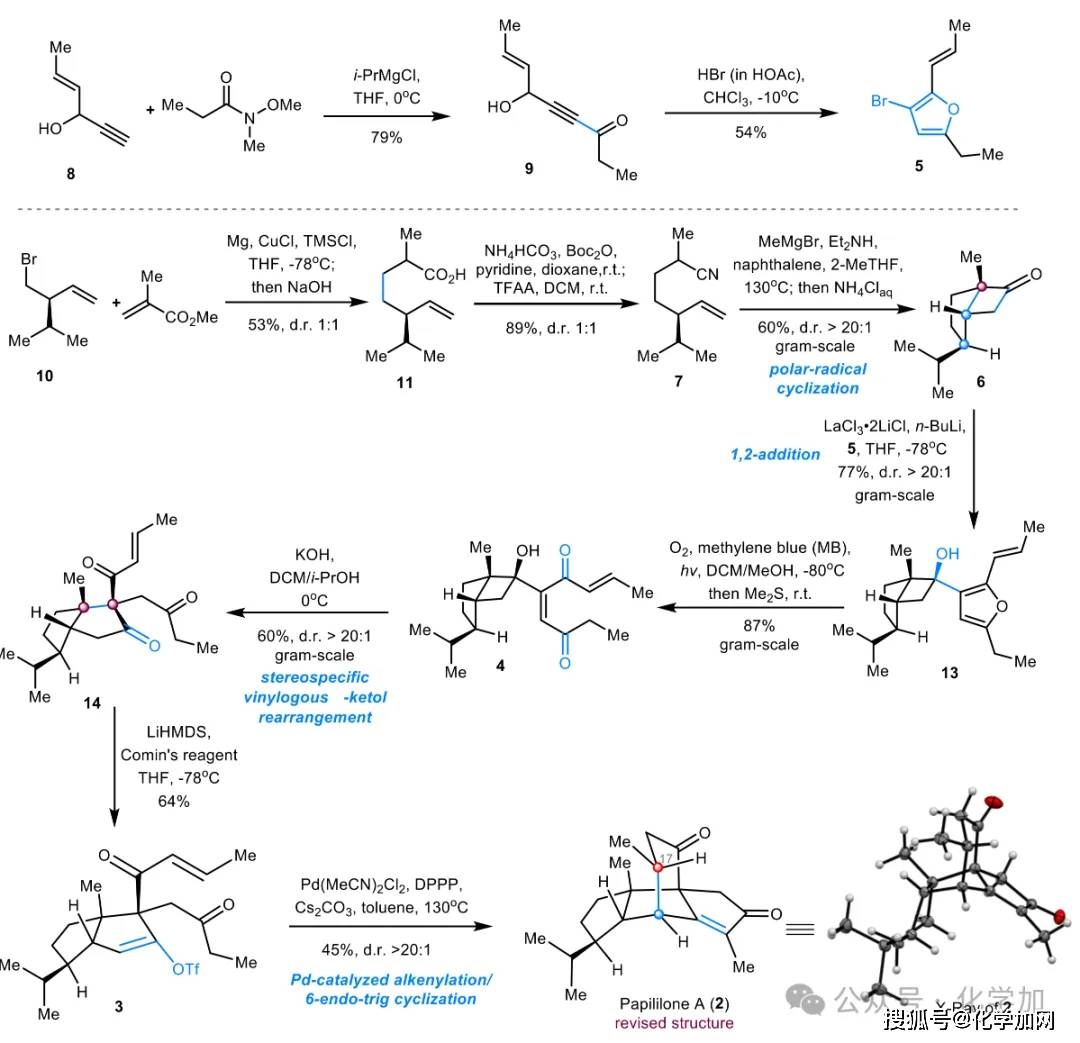
图6. 天然产物papililone A的合成路线
上海交通大学药学院2023级博士研究生单兴钱为论文第一作者,侯四化长聘教轨副教授为论文通讯作者。
文献详情:
Xing-Qian Shan, Xiang Zhang, Peng-Fei Zheng, Bao-Kuan Guo, Yong-Qiang Tu, Si-Hua Hou*
Convergent Total Synthesis of Papililone A via Pd-Catalyzed Alkenylation/Cyclization Cascade.
J. Am. Chem. Soc. 2025, 10.1021/jacs.5c17278
https://doi.org/10.1021/jacs.5c17278
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn