

(图片来源:J. Am. Chem. Soc.)
正文
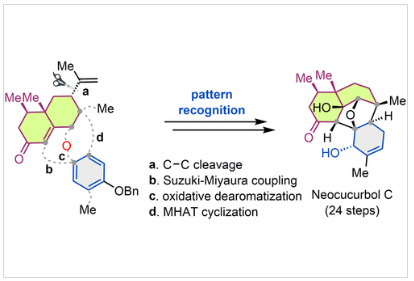
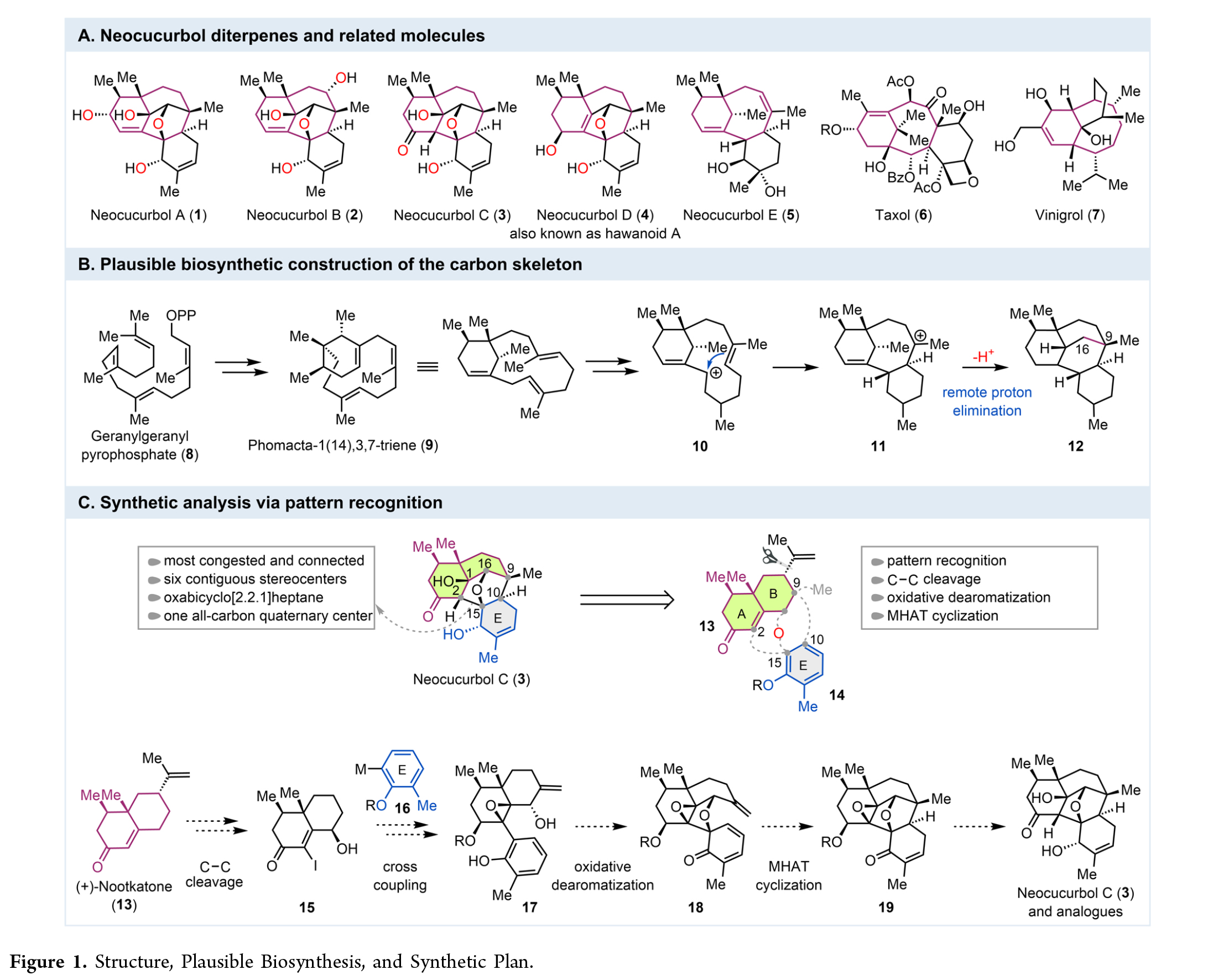
Neocucurbols (1-5) 是一类由深海真菌Neocucurbitaria unguis-hominis产生的二萜类天然产物。其核心结构特征在于neocucurbols A-D (1-4) 拥有一个罕见的[6.6.5.5.6]五环稠合骨架,内含三个桥环体系(包括双环[5.3.1]十一烷、双环[3.3.1]壬烷和氧杂双环[2.2.1]庚烷)及多达九个手性中心。而neocucurbols E-H则具有独特的[6.8.6]三环骨架。该家族复杂的环系和多手性中心使其成为极具挑战性的合成目标,其骨架与紫杉醇和vinigrol等著名天然产物相类似。但是到目前为止,尚无关于neocucurbols的全合成报道。近日,美国伊利诺伊大学芝加哥分校Alexander Adibekian课题组与美国埃默里大学代明骥课题组首次报道了neocucurbol C (3) 的不对称全合成。其合成策略基于对分子结构的模式识别分析,计划从手性分子(+)-nootkatone (13) 出发。首先,通过Kwon等人发展的选择性C-C键断裂方法切除其异丙烯基,得到关键十氢萘中间体15。随后,通过Suzuki-Miyaura偶联反应将取代苯环(E环前体)连接至十氢萘上,构建C2-C15键。接着,关键的氧化去芳构化环化反应将形成C15-O键并构筑氧杂双环[2.2.1]庚烷,但此步骤中螺环中心的立体控制是一大挑战。最后,作者设想通过一个极具挑战性的金属催化氢原子转移(MHAT:metal-catalyzed hydrogen atom transfer)引发的自由基环化反应,在δ-位进行偶联,以构建关键的C9-C10键及C9季碳中心,从而完成整个五环骨架的组装(Figure 1)。欢迎下载化学加APP到手机桌面,合成化学产业资源聚合服务平台。
(图片来源:J. Am. Chem. Soc.)
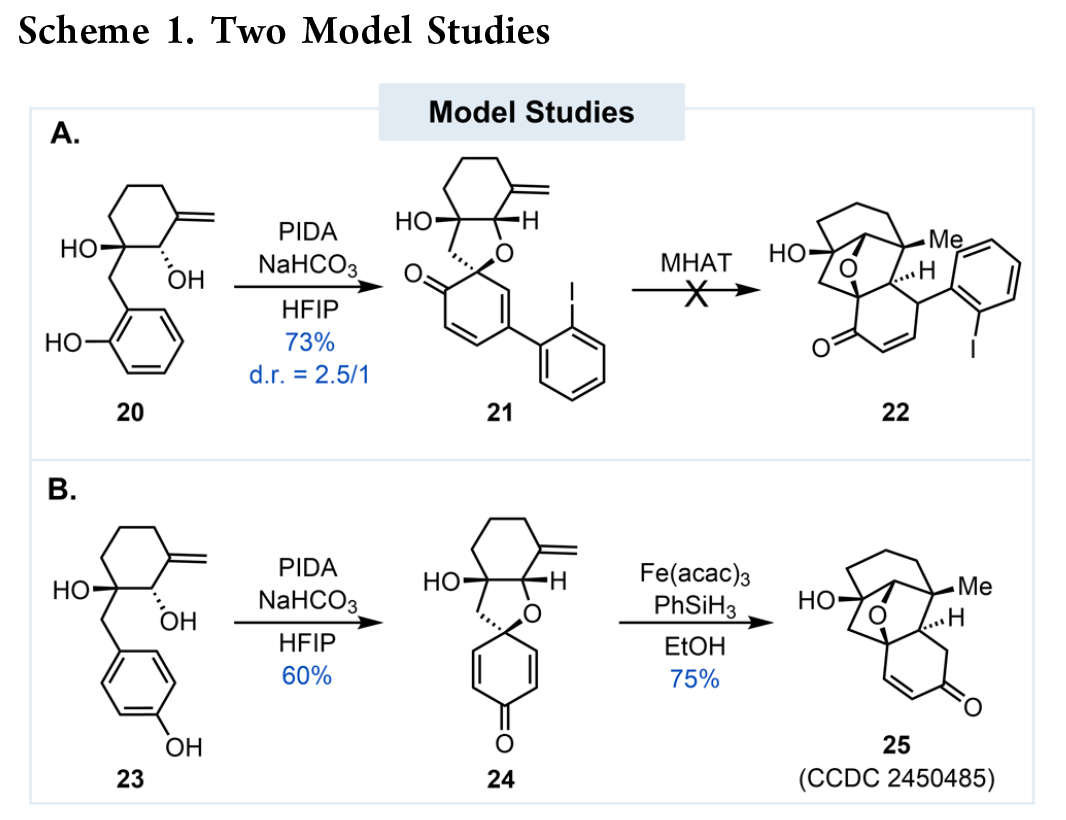
为了对设计的两个关键环化步骤进行评估,作者首先进行了模型研究(Scheme 1A)。首先,作者制备了模板底物 20,并对其氧化去芳构化环化反应进行了探索。当20在PIDA/HFIP 体系下反应时,未能得到预期的环化产物。相反,作者以 73% 的收率(d.r. = 2.5/1)分离得到了副产物21及其差向异构体。尽管这表明氧化去芳构化环化得以发生,但其非对映选择性较低。作者系统性地筛选了多种反应条件和高价碘试剂,但均未能有效抑制该副产物的生成。鉴于无法避免21的生成,作者尝试将其作为测试分子,用于后续的MHAT 环化研究,但该尝试同样未能成功。
面对上述双重失败,作者对反应机理进行了深入分析,并将芳环上的羟基从邻位移至对位。这一策略变动虽然会增加后期E 环官能团化的合成步骤,但预期可以带来以下优势:1)从根本上消除邻位羟基导向的碘苯基 γ-加成副反应;2)避免了由邻位羟基参与环化带来的低非对映选择性难题;3)提升 MHAT 反应活性。为验证这一新策略,作者制备了新的模板底物 23。当23在PIDA/HFIP 条件下,可以顺利以 60% 的收率得到预期的产物 24,且未观察到碘苯基加成副产物。随后,24在 Fe(acac)₃/PhSiH₃ 体系下,成功发生 MHAT 环化,以 75% 的高收率得到目标产物 25(Scheme 1B)。
(图片来源:J. Am. Chem. Soc.)
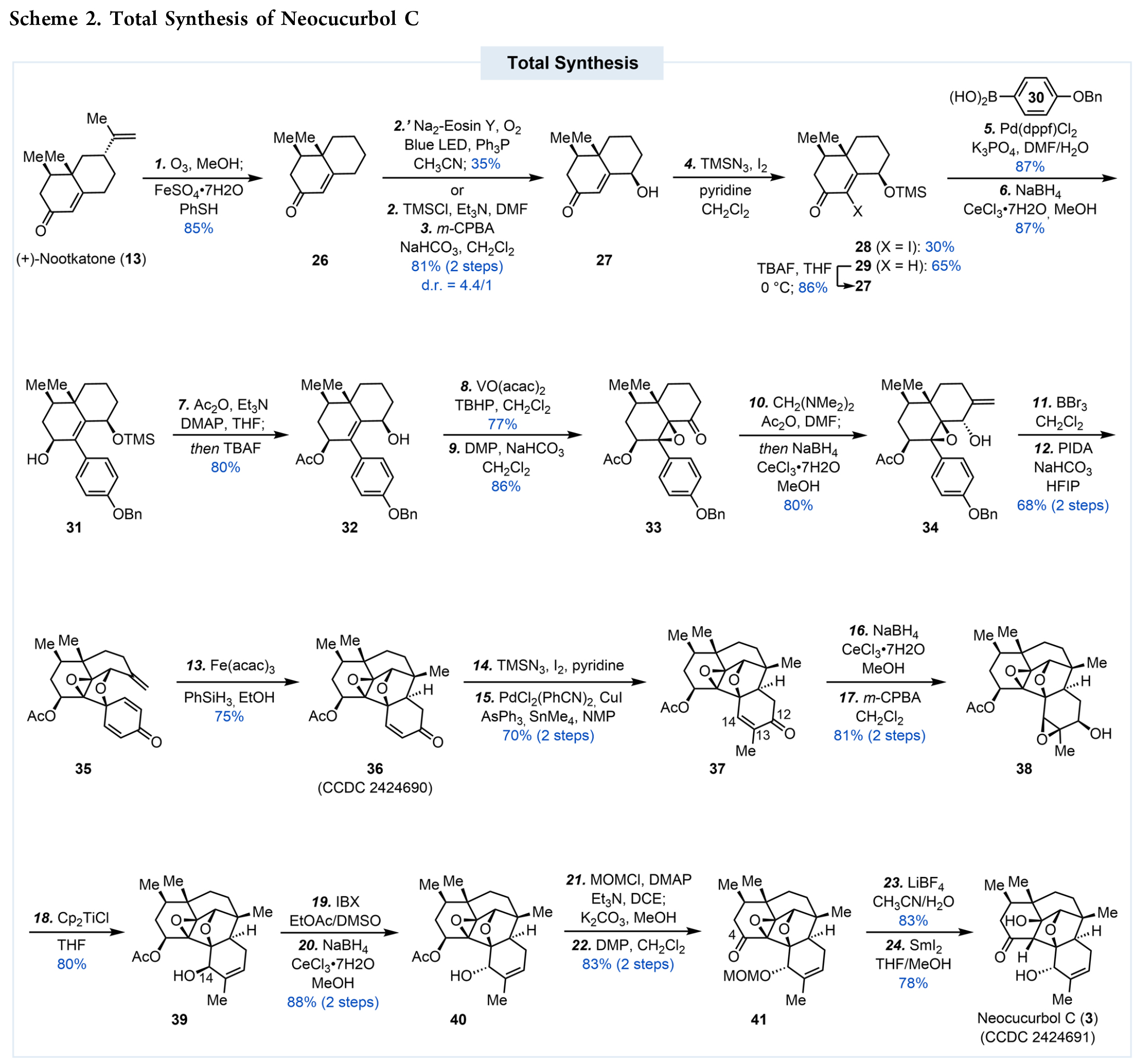
作者以商品化原料(+)-nootkatone为起始原料展开全合成(Scheme 2)。首先采用Kwon开发的氢化脱烯基键断裂反应,成功在克级规模上以85%收率去除异丙烯基,获得中间体26。随后作者系统考察了烯酮γ-位羟基化的多种方案,最终选择经典的两步法(硅烯醇醚形成与m-CPBA氧化),在克级规模以81%收率(非对映异构体比例4.4:1)获得27及其差向异构体。
为了后续的偶联,作者通过TMSN₃/碘组合在烯酮α-位引入碘原子。其中TMSN₃作为路易斯酸活化烯酮,而叠氮化物作为小位阻亲核试剂进行共轭加成。该反应中仲羟基同时被TMS保护,生成28和29。虽然目标产物28收率仅30%,但副产物29可通过TBAF处理再生为27进行循环利用,有效避免了物料损失。
随后,作者以Pd(dppf)Cl₂为催化剂,28与硼酸30顺利发生Suzuki-Miyaura偶联,产物经Luche还原得到31。通过一锅法完成乙酰基保护与TMS脱除后,31被转化为32。值得注意的是,所得全取代环氧化物表现出异常稳定性,能完整保留至后续还原开环步骤。仲羟基经Dess-Martin氧化得到酮33后,采用N,N,N′,N′-四甲基乙二胺作为温和的曼尼希试剂,成功引入关键α-亚甲基,并实现原位立体选择性还原,以80%收率获得34。BBr₃脱除苄基后,产物因可能通过环氧化物开环形成对醌甲基化物而不稳定,需立即进行下一步氧化去芳构化环化。粗品酚在HFIP中用PIDA处理,以68%的收率得到35。最后经Fe(acac)₃/PhSiH₃引发的还原性自由基环化,以75%收率构建完整neocucurbol骨架,获得目标化合物36。
在获得关键中间体36后,需通过外围修饰引入额外甲基并调控氧化态。作者采用α-碘代和Stille偶联两步策略,以70%收率在C13位成功引入甲基得到37。随后需解决氧官能团从C12位向C14位迁移的关键问题。首先将酮羰基还原为仲醇以引导m-CPBA环氧化反应,以81%收率获得环氧化物38;随后通过二茂钛促进的还原性消除得到C14位构型不符的39,再经IBX氧化-Luche还原两步进行构型校正。值得注意的是,38中环氧化物与仲醇的相对立体构型对二茂钛介导的环氧醇还原消除具有决定性影响。
为完成neocucurbol C的全合成,作者先将40的仲醇用MOM保护,并完成C4位乙酸酯水解及DMP氧化得到酮41。经LiBF₄脱除MOM保护基后,通过SmI₂介导的环氧化物还原开环,以78%收率获得neocucurbol C。此外,作者通过X-射线单晶衍射分析确证了合成产物的结构和绝对构型。
 (图片来源:J. Am. Chem. Soc.)
(图片来源:J. Am. Chem. Soc.)
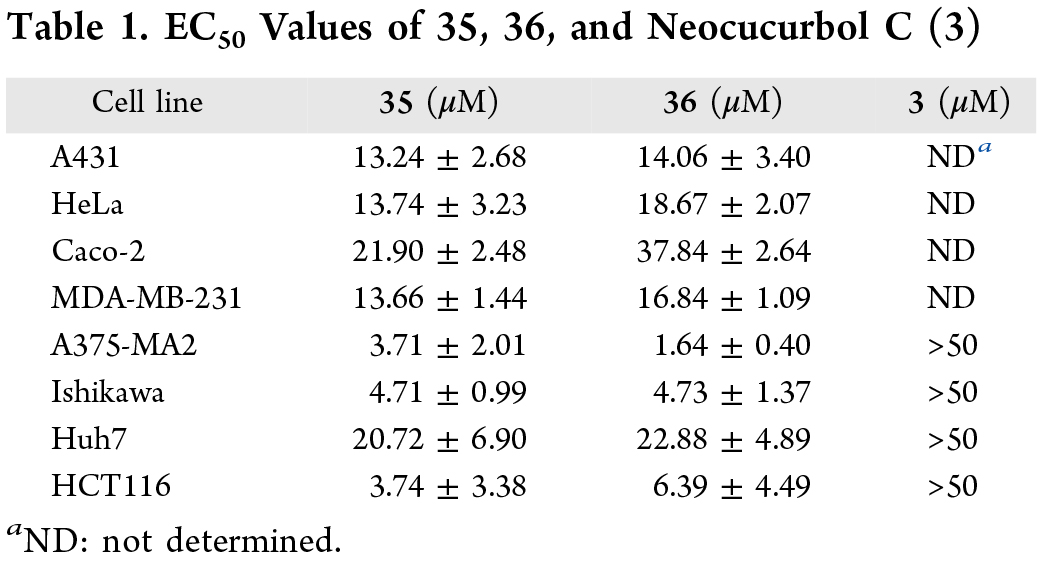
尽管已有文献报道Neocucurbol C及其天然类似物对多种人类癌细胞系无细胞毒性,作者仍推测本合成路线中所生成的中间体可能具有潜在生物活性。为此,作者对Neocucurbol C及10种合成中间体进行了多株癌细胞系的活性评估(。实验结果显示,Neocucurbol C确实未表现出细胞毒性,但化合物35和36却展现出显著的细胞毒效应,其对不同癌细胞的EC50值介于1.64 μM至37.84 μM之间(Table1)
(图片来源:J. Am. Chem. Soc.)
总结
Alexander Adibekian与代明骥课题组以24步反应首次完成了neocucurbol C的全合成。通过模式识别分析,作者利用商品化原料(+)-nootkatone作为起始物,并采用Kwon开发的氢化脱烯基反应去除异丙烯基。以芳香化合物作为E环前体,通过Suzuki-Miyaura偶联将其引入AB环体系。随后通过氧化去芳构化及MHAT还原环化反应,高效构建了氧杂双环[2.2.1]庚烷核心骨架。尽管后续的外围修饰步骤较预期更为冗长,但该过程产生了多个具有neocucurbol骨架的合成中间体用于生物活性评价,其中化合物36及其前体35展现出显著的抗癌活性,具有深入研究价值。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn